Eleganter Mechanismus
Bio-News vom 06.02.2019
Forschende entdecken Verknüpfung von Metabolit- und Proteintransport in den Kraftwerken der Zellen.
Den Arbeitsgruppen von Privatdozent Dr. Thomas Becker und Prof. Dr. Nikolaus Pfanner vom Institut für Biochemie und Molekularbiologie der Universität Freiburg ist es gelungen, gemeinsam eine Funktion des Metabolitkanals der Außenmembran der Mitochondrien im Proteintransport zu entdecken. Die Forscherinnen und Forscher haben die Ergebnisse in der Fachzeitschrift Molecular Cell publiziert.
Im Stoffwechsel der Zelle spielen Mitochondrien eine zentrale Rolle. Besonders ihre Funktion bei der Produktion der Energie für die Zelle ist bekannt, weshalb Wissenschaftlerinnen und Wissenschaftler sie auch als Kraftwerk der Zelle bezeichnen. Defekte im Stoffwechsel der Mitochondrien können zu schweren Erkrankungen insbesondere des Herzmuskels und des Nervensystems führen. Mitochondrien sind auf den Austausch von Stoffwechselprodukten, den Metaboliten, mit der umgebenden Zelle angewiesen. Dazu müssen die Metabolite über die zwei umgebenden Membranen transportiert werden. Der Kanal Porin/VDAC transportiert Metabolite über die Außenmembran der Mitochondrien, während mehrere spezifische Transporter, die sogenannten Carrier, den Metabolittransport über die Innenmembran vermitteln.
Publikation:
Ellenrieder, L., Dieterle, M.P., Doan, K.N., Mårtensson, C.U., Floerchinger, A., Campo, M.L., Pfanner, N., and Becker, T.
Dual role of mitochondrial porin in metabolite transport across the outer membrane and protein transfer to inner membrane
Molecular Cell
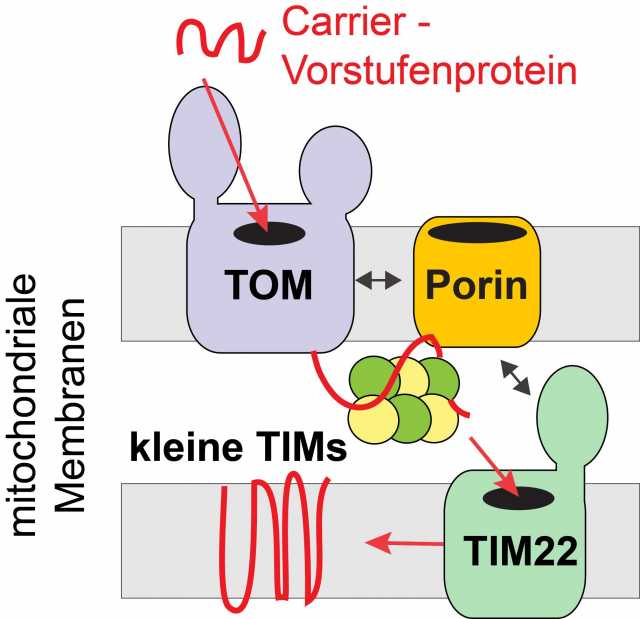
Mitochondrien sind zudem auf den Import von etwa 1.000 verschiedenen Proteinen, den so genannten Vorstufenproteinen, aus der Zellflüssigkeit, angewiesen. Die Translokase der äußeren Membran, auch TOM-Komplex genannt, bildet die Eintrittspforte für die Vorstufenproteine in die Mitochondrien. Einen wichtigen Importweg stellt dabei der Transport von Carrier-Vorstufenproteinen in die Innenmembran dar. Diese werden von Carrierproteinen durch den TOM-Komplex über die Außenmembran transportiert und durch Helferproteine, den kleinen TIMs, durch den Intermembranraum zu der Innenmembran gebracht. Die Carrier-Translokase, der TIM22-Komplex, baut die Carrierproteine dann in die Innenmembran ein. Wie die Transportschritte an der Außen- und Innenmembran miteinander abgestimmt werden, war bislang gänzlich unbekannt.
Die Freiburger Forschenden des Sonderforschungsbereichs „Funktionelle Spezifität durch Kopplung und Modifikation von Proteinen“, dem Graduiertenkolleg „Transport über und in Membranen“ und dem Exzellenzcluster CIBSS Center for Integrative Biological Signalling Studies der Universität Freiburg haben eine unerwartete Funktion des Metabolitkanals Porin/VDAC in diesem Transportweg entdeckt: Dr. Lars Ellenrieder aus der Arbeitsgruppe von Thomas Becker konnte nachweisen, dass Porin/VDAC den Import von Carrier-Vorstufenproteinen in die Innenmembran stimuliert. Die Funktion von Porin/VDAC im Proteintransport ist unabhängig von dessen Kanalaktivität, stattdessen fungiert Porin/VDAC hier als Kopplungsfaktor und bindet so das Vorstufenprotein im Intermembranraum. Darüber hinaus interagiert das Protein mit dem TOM-Komplex und der Carrier-Translokase, wodurch es den Proteintransport stimuliert.
Die Ergebnisse der Arbeit zeigen damit eine überraschende Verknüpfung von Metabolit- und Proteintransport auf: „Die Rolle von Porin/VDAC stellt einen eleganten Mechanismus dar, den Import von Carrier-Vorstufenproteinen und damit letztendlich den Metabolittransport an den Stoffwechsel der Zelle anzupassen“, erklärt Becker.
Diese Newsmeldung wurde via Informationsdienst Wissenschaft erstellt.