Mechanismus der Biomineralisation enthüllt
Bio-News vom 13.01.2024
Wie stellen lebende Organismen Mineralien her – zum Beispiel für ihre Schale? Forschende der Universität Konstanz und der Leibniz Universität Hannover sind der Antwort auf diese Frage ein entscheidendes Stück nähergekommen. In einer gemeinsamen Studie entschlüsselten sie den Entstehungsmechanismus von amorphem Calciumcarbonat, einem wichtigen Zwischenprodukt der Biomineralisation.
Viele Lebewesen sind in der Lage, Mineralien oder mineralisiertes Gewebe herzustellen. Ein bekanntes Beispiel ist Perlmutt, das wegen seiner schillernden Farben auch in Schmuck Verwendung findet.
Publikation:
Gindele, M.B., Vinod-Kumar, S., Rochau, J. et al.
Colloidal pathways of amorphous calcium carbonate formation lead to distinct water environments and conductivity
Nat Commun 15, 80 (2024)
DOI: 10.1038/s41467-023-44381-x
Chemisch betrachtet beginnt dessen Entstehung damit, dass Weichtiere dem Wasser Calcium- und Carbonat-Ionen entziehen. Welche genauen Prozesse und Bedingungen aber letztendlich zu dem als Perlmutt bekannten Verbundstoff aus Biopolymeren und kristallinen Calciumcarbonatplättchen führen, ist Teil einer intensiven Debatte unter Expertinnen und Experten, und es gibt unterschiedliche Theorien.
Einigkeit herrscht darin, dass bei der Biomineralisation nicht-kristalline Zwischenprodukte, wie das amorphe Calciumcarbonat (ACC), eine wichtige Rolle spielen. So halten beispielsweise Hummer und andere Schalentiere einen ACC-Vorrat in ihren Mägen bereit, den sie nach der Häutung für den Aufbau einer neuen Schale verwenden. In einer aktuellen Studie in Nature Communications ist es Forschenden der Universität Konstanz und der Leibniz Universität Hannover nun gelungen, den Entstehungsmechanismus von ACC zu entschlüsseln.
Eine Kombination fortschrittlicher Methoden
Die Forschenden um Denis Gebauer (Leibniz Universität Hannover) und Guinevere Mathies (Universität Konstanz) nutzten dafür ihre gebündelte Expertise und die Tatsache, dass ACC nicht nur von lebenden Organismen, sondern auch im Labor synthetisiert werden kann. Mit fortschrittlichen Methoden, wie der Magic-Angle-Spinning Kernspinresonanzspektroskopie (MAS NMR), untersuchten sie winzige ACC-Partikel, um deren Struktur aufzuklären. „Wir hatten allerdings große Mühe, die Spektren von ACC zu interpretieren. Sie deuteten auf Dynamiken hin, die wir zunächst nicht modellieren konnten“, so Mathies.
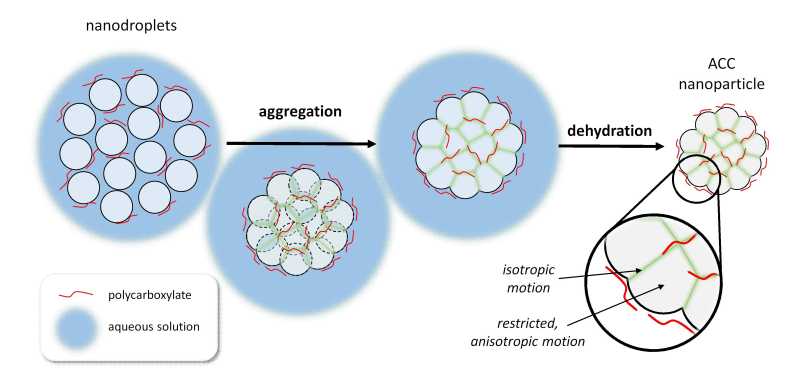
Den entscheidenden Hinweis lieferten die Kolleginnen und Kollegen aus Hannover. Maxim Gindele aus der Arbeitsgruppe von Denis Gebauer zeigte, dass ACC elektrischen Strom leitet. Da die Partikel sehr zerbrechlich sind und lediglich eine Größe von wenigen Nanometern ausweisen – das entspricht in etwa dem tausendsten Bruchteil der Dicke eines menschlichen Haares –, können sie allerdings nicht einfach verkabelt werden. Stattdessen erfolgten die Messungen über ein Leitfähigkeits-Rasterkraftmikroskop (C-AFM), in dem ACC-Partikel auf einer ebenen Oberfläche durch einen winzigen Messarm (Cantilever), der die Oberfläche abtastet, detektiert und mit Hilfe eines Laserstrahls sichtbar gemacht werden. Befindet sich der Messarm auf einem der Partikel, kann durch dessen Spitze Strom geleitet werden, um die Leitfähigkeit zu messen.
Zwei unterschiedliche Umgebungen
Mit der Beobachtung der elektrischen Leitfähigkeit im Hinterkopf führte Sanjay Vinod Kumar aus der Arbeitsgruppe von Guinevere Mathies dann weitere MAS NMR Experimente zur Untersuchung der Dynamiken durch. Es zeigte sich, dass es in den ACC-Partikeln zwei unterschiedliche chemische Umgebungen gibt. In der einen können sich Wassermoleküle lediglich eingeschränkt um die eigene Achse drehen, mit sogenannten 180 Grad-Flips. In der anderen Umgebung sind die Wassermoleküle beweglicher und können langsame Taumel- und Translationsbewegungen durchführen, wobei auch ladungstragende Hydroxid-Ionen vorhanden sind. „Die letzte verbleibende Herausforderung war dann, diese beiden Umgebungen mit der beobachteten Leitfähigkeit in Einklang zu bringen. Feste Salze und Mineralien sind eigentlich Nichtleiter, die mobile Umgebung musste also eine Rolle spielen“, berichtet Mathies. In dem neuen Modell bilden die beweglicheren Bereiche ein Netzwerk innerhalb der ACC-Partikel, mit Hydroxid-Ionen als Ladungsträger.
Die Forschenden haben auch eine schlüssige Erklärung für die Entstehung der beiden chemischen Umgebungen: Calcium- und Carbonat-Ionen neigen in Wasser dazu, sich zu sich ständig verändernden Teilchen-Ansammlungen – sogenannten Pränukleationsclustern – zusammenzufinden. Diese Cluster können eine Phasentrennung durchlaufen und dichte, flüssige Nanotröpfchen bilden, die sich wiederum zu größeren Gruppierungen zusammentun – vergleichbar mit Seifenblasen, die miteinander verschmelzen. „Die starre, unbewegliche Umgebung stammt aus dem inneren Kern der dichten, flüssigen Nanotröpfchen. Das Netzwerk der beweglichen Wassermoleküle bleibt dagegen während der Trocknung zu festem ACC als Überrest einer unvollständigen Verschmelzung der Tröpfchenoberflächen bestehen“, erläutert Gebauer.
Die Ergebnisse sind ein wesentlicher Schritt in Richtung eines Strukturmodells von ACC. Gleichzeitig sind sie ein stichhaltiges Indiz dafür, dass Mineralisierung mit der Bildung von Pränukleationsclustern beginnt. „Das bringt uns nicht nur einem besseren Verständnis der Geheimnisse der Biomineralisation ein großes Stück näher, sondern kann z.B. auch bei der Entwicklung von Kohlenstoffdioxid-fixierenden Zementmaterialien zur Anwendung kommen – oder, da wir jetzt wissen, dass ACC ein Leiter ist, in elektrochemischen Bauteilen“, schließt Mathies.
Diese Newsmeldung wurde mit Material der Universität Konstanz via Informationsdienst Wissenschaft erstellt.