Forschung liefert neue Erkenntnisse zur Funktionsweise von Enzymen
Bio-News vom 28.01.2020
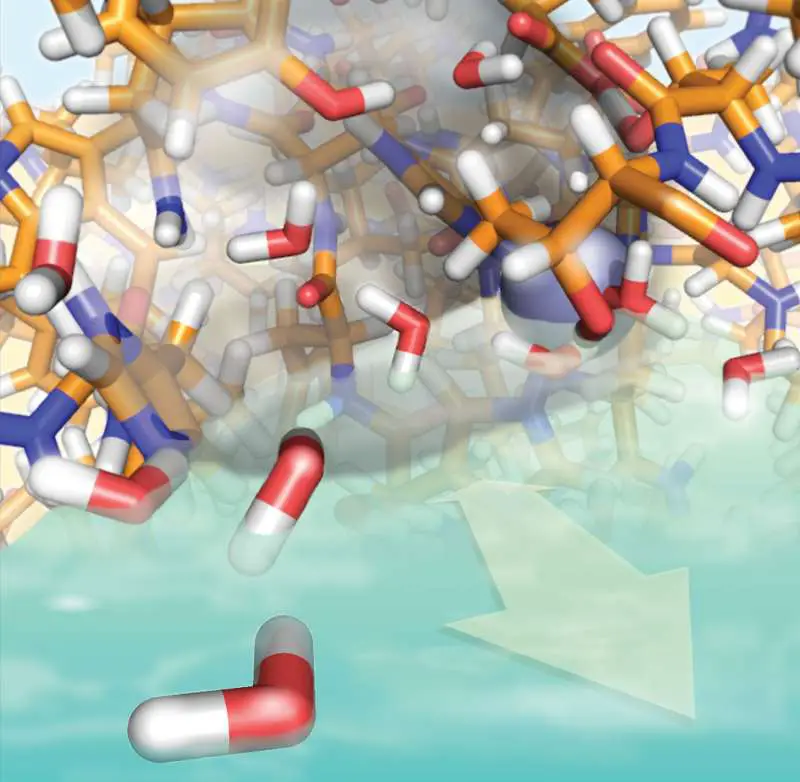
Proteine gelten als „Bausteine des Lebens“, da viele chemische Reaktionen mit ihrer Hilfe erfolgen und Zellkommunikation und -bewegung von ihnen abhängig sind. Wer Proteine versteht, kann erforschen, wie bestimmte Krankheiten entstehen oder warum gewisse Umwelteinflüsse krebserregend sind. Das Team um Rasmus Linser, Professor für Physikalische Chemie an der TU Dortmund, hat nun mithilfe innovativer Methoden mehr über die dynamischen Abläufe eines medizinisch wichtigen Enzyms herausgefunden. Enzyme sind Proteine, und das untersuchte Enzym ist auch für viele andere Proteine repräsentativ. Die Ergebnisse wurden kürzlich im „Journal of the American Chemical Society“ veröffentlicht.
Prof. Rasmus Linser forscht an der TU Dortmund schwerpunktmäßig zu Methoden, mit denen man Proteine und ihre Beweglichkeit untersuchen kann. Jetzt haben er und sein Team gemeinsam mit Kollegen von der Ruhr-Universität Bochum und der Ludwig-Maximilians-Universität München mithilfe dieser Methoden neue Erkenntnisse über ein Protein erzielt, das schon seit vielen Jahren im Fokus der pharmakologischen Forschung steht. Das Enzym hCAII, die humane Carboanhydrase, kommt beinahe überall im Körper vor. Es sorgt als Katalysator dafür, dass Kohlenstoffdioxid und Wasser sich zu Kohlensäure verbinden – und umgekehrt. Diese Reaktion läuft in einer eigens dafür vorgesehenen Tasche des Enzyms ab, die auch „aktives Zentrum“ genannt wird.
Publikation:
Himanshu Singh, Suresh K. Vasa, Harish Jangra, Petra Rovó, Christopher Päslack, Chandan K. Das, Hendrik Zipse, Lars V. Schäfer, Rasmus Linser
Fast Microsecond Dynamics of the Protein–Water Network in the Active Site of Human Carbonic Anhydrase II Studied by Solid-State NMR Spectroscopy
J. Am. Chem. Soc. 2019, 141, 49, 19276-19288
DOI: 10.1021/jacs.9b05311
Was genau in diesem Zentrum passiert, haben die Forscher mit der sogenannten Festkörper-NMR-Spektroskopie untersucht. Prof. Rasmus Linser ist Spezialist für diese Methode, deren Besonderheit darin besteht, dass sie Informationen über Vorgänge auf einer ganz bestimmten Zeitskala liefern kann – nämlich im Mikro- bis Millisekunden-Bereich. „Es gibt unterschiedliche Zeitskalen, die für die Erforschung von Proteinen spannend sind“, sagt Linser.
„Ganz schnelle Bewegungen lassen sich zum Beispiel mit herkömmlicher NMR-Spektroskopie gut untersuchen. Langsame Bewegungen kann man über Echtzeitexperimente nachvollziehen. Im Mikro- bis Millisekunden-Bereich ist es aber besonders schwer, Informationen zu bekommen.“ Diese Zeitskala ist aber von besonderer Wichtigkeit für die Funktionalität von Proteinen als Enzyme sowie ihre Rolle in der Kommunikation innerhalb der Zelle. Aus diesem Grund hat Linser in den vergangenen Jahren die Festkörper-NMR-Spektroskopie weiterentwickelt. Die Methode untersucht Proteine in fester Phase und ist besonders gut für größere Strukturen geeignet.
Das in der aktuellen Arbeit untersuchte Enzym wurde bislang hauptsächlich mit kristallographischen Methoden erforscht, die Temperaturen von minus 200 Grad erfordern. Das führte dazu, dass Bewegungen, die bei normaler Körpertemperatur stattfinden, nicht erkennbar waren. Deshalb haben sich Wissenschaftlerinnen und Wissenschaftler das Enzym bislang als steifes, nicht flexibles Konstrukt vorgestellt. „Wir konnten nun erstmals beobachten, dass tatsächlich auf der von uns untersuchten Zeitskala, auf der auch die wichtige enzymatische Katalyse dieses Enzyms stattfindet, deutliche Bewegung im aktiven Zentrum existiert“, berichtet Linser.
Das Team konnte zeigen, dass sich nicht nur das aktive Zentrum des Enzyms auf der Mikrosekundenzeitskala bewegt, sondern auch das Wassernetzwerk, welches darin sitzt. Das Spannende dabei: Die Wassermoleküle besetzen immer wieder ganz bestimmte Stellen in der Tasche. Die einzelnen Wassermoleküle bleiben allerdings nicht lange auf ihren vorgegebenen Plätzen, sondern werden bereits nach Nanosekunden, also nach einer Zeit noch viel kürzer als Mikrosekunden, wieder ausgetauscht. Das könne man sich vorstellen wie bei einem Bus, in dem ständig neue Menschen sitzen – jedoch immer auf den durch die jeweilige Architektur des Innenraumes vorgegebenen Plätzen, so Linser.
Obwohl die einzelnen Wassermoleküle kaum verweilen, zeigen sich auch auf der Mikrosekundenzeitskala Veränderungen in der Struktur – d. h. der vorgegebenen Plätze – des Wassernetzwerks. Die Veränderungen der Wasserstruktur, so leiten die Forscher ab, könnten einen eigenen Beitrag zur Katalyse leisten, für die die Wasserinteraktionen eine wichtige Komponente sind. Diese Erkenntnis liefert Ansatzpunkte für weitere Arbeiten, zum Beispiel von Kolleginnen und Kollegen aus der Biotechnologie, die sich mit der Nutzung von Enzymen in technischen Anwendungen beschäftigen.
Dass das Wasser eine Rolle auf dieser langsamen, für die Katalyse wichtigen Zeitskala spielt, ist auch eine wichtige Information für die Wissenschaftlerinnen und Wissenschaftler von Resolv. Im Exzellenzcluster der TU Dortmund und der Ruhr-Universität Bochum erforschen sie, wie Lösungsmittel in die Kontrolle, Vermittlung und Steuerung chemischer Reaktionen involviert sind.
Diese Newsmeldung wurde mit Material der Technischen Universität Dortmund via Informationsdienst Wissenschaft erstellt.