„Molekulare Schere“ für den Plastikmüll möglich
Bio-News vom 12.04.2019
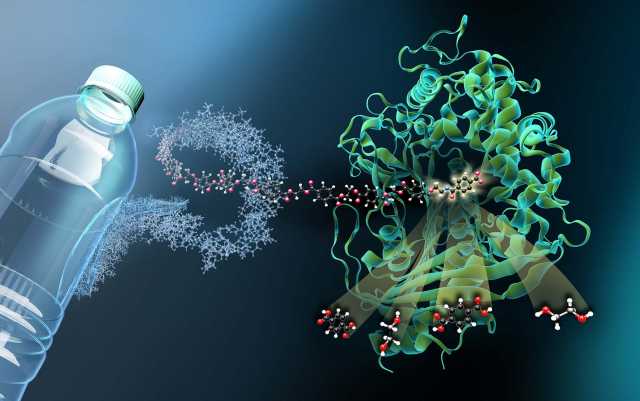
Ein Team der Universität Greifswald und des Helmholtz-Zentrums Berlin (HZB) hat an der Synchrotronlichtquelle BESSY II die Struktur eines wichtigen Enzyms („MHETase“) entschlüsselt. Die MHETase wurde in einem Bakterium entdeckt. Sie ist in der Lage, zusammen mit einem zweiten Enzym, der PETase, den weit verbreiteten Kunststoff PET in seine Grundbausteine zu zerlegen. Die 3D-Struktur der MHETase ermöglichte es den Forschern bereits, die Aktivität dieses Enzyms gezielt zu optimieren, um es zusammen mit der PETase für das nachhaltige Recycling von PET zu nutzen.
Kunststoffe sind wunderbare Materialien: extrem vielseitig und nahezu ewig haltbar. Doch genau das ist auch ein Problem, denn nach nur rund 100 Jahren Kunststoffproduktion befinden sich inzwischen Plastikpartikel überall, im Grundwasser, in den Ozeanen, in der Luft und in der Nahrungskette. Nur ein winziger Bruchteil der Kunststoffe wird aktuell durch energie- und kostenintensive Verfahren recycelt, wobei sie bisher deutlich an Qualität verlieren oder wiederum von ‚frischem‘ Rohöl abhängen. Ein wichtiger industrieller Kunststoff ist PET, von dem jährlich ca. 50 Millionen Tonnen neu hergestellt werden.
Erst 2016 hat eine Gruppe japanischer Forscher ein Bakterium entdeckt, das auf PET-Kunststoffen wachsen und sich teilweise davon ernähren kann. Wie sie herausfanden, besitzt dieses Bakterium zwei besondere Enzyme, die in der Lage sind, PET-Kunststoff abzubauen: PETase und MHETase. Zunächst zerlegt die PETase den Kunststoff in kleinere Bausteine, vorwiegend MHET, dann spaltet die MHETase diese in die zwei PET-Grundbausteine, Terephthalsäure und Ethylenglykol. Beide Bausteine sind sehr wertvoll für eine Neusynthese von PET – so dass erstmals ein nachhaltiger geschlossener Recyclingkreislauf – ohne Verwendung von Erdöl – möglich wird.
Publikation:
Gottfried J. Palm, Lukas Reisky, Dominique Böttcher, Henrik Müller, Emil A. P. Michels, Miriam C. Walczak, Leona Berndt, Manfred S. Weiss, Uwe T. Bornscheuer & Gert Weber
Structure of the plastic-degrading Ideonella sakaiensis MHETase bound to a substrate
Nature Communicationsvolume 10, Article number: 1717 (2019)
DOI: 10.1038/s41467-019-09326-3
Im April 2018 gelang es mehreren Arbeitsgruppen schließlich, die Struktur des Enzyms PETase aufzuklären, auch Experimente an der Lichtquelle Diamond waren daran beteiligt. Doch die PETase ist nur ein Teil der Lösung, genauso wichtig ist es, die Struktur des zweiten Enzyms, der MHETase, zu erhalten.
„Die MHETase ist deutlich größer als die PETase und noch komplexer. Ein einziges MHETase-Molekül besteht aus 600 Aminosäuren, das sind mehr als 4000 Atome. Die MHETase besitzt eine Oberfläche, die etwa doppelt so groß ist wie die von PETase. Damit gibt es auch wesentlich mehr Optionen, die Oberfläche dieses Enzyms zu modifizieren und für die Zerlegung von PET zu optimieren“, erklärt der Biochemiker und Strukturbiologe Dr. Gert Weber von der gemeinsamen Forschungsgruppe Proteinkristallographie am Helmholtz-Zentrum Berlin https://www.helmholtz-berlin.de und der Freien Universität Berlin https://www.fu-berlin.de.
Als Vertretungsprofessor an der Universität Greifswald nahm Prof. Dr. Weber 2016 dort Kontakt mit Prof. Dr. Uwe Bornscheuer am Institut für Biochemie https://biochemie.uni-greifswald.de auf, der sich bereits mit plastikabbauenden Enzymen beschäftigte. Gemeinsam entwickelten sie die Idee, auch die Struktur der MHETase zu entschlüsseln und mit Hilfe dieser Einsicht das Enzym für den PET-Abbau zu optimieren. Dazu mussten sie zunächst das Enzym aus Bakterienzellen gewinnen und im Anschluss reinigen. In dieser Kooperation ist es nun gelungen, an der Synchrotronlichtquelle BESSY II https://www.helmholtz-berlin.de/quellen/bessy/index_de.html am HZB in Berlin die dreidimensionale komplex gefaltete Architektur von MHETase zu entschlüsseln. Dabei wurde das in der Anlage erzeugte besonders brillante Röntgenlicht genutzt.
„Damit man in der Struktur sieht, wie das Enzym an PET bindet und es zersetzt, benötigt man ein Plastikfragment, das an MHETase bindet, aber nicht gespalten wird“, erklärt Dr. Weber. Ein Mitarbeiter aus dem damaligen Arbeitskreis Weber an der Universität Greifswald, Dr. Gottfried Palm, zerschnitt dafür eine PET-Flasche, zersetzte das PET chemisch und synthetisierte daraus ein kleines Plastikfragment, das an MHETase binden, aber von dieser nicht mehr gespalten werden kann. Aus dieser ‚blockierten‘ MHETase wurden dann am HZB winzige Kristalle für die Strukturuntersuchungen gezüchtet. „Durch diese Strukturuntersuchungen können wir der MHETase gewissermaßen ‚bei der Arbeit zuschauen‘ und daraus Strategien entwickeln, das Enzym zu optimieren“, erläutert Dr. Weber.
„Durch die gemeinsame Forschungsgruppe haben wir an BESSY II die Möglichkeit, jederzeit sehr rasch an den viel gebuchten MX-Beamlines Messzeit anzubieten“, sagt Dr. Manfred Weiss, der für die MX-Beamlines, verantwortlich ist. Die MX-Beamlines (MX steht für Makromolekulare Kristallographie) sind darauf spezialisiert, winzige kristalline Proben aus organischen, sehr großen Molekülen zu durchleuchten, aus den Daten lassen sich die 3D-Faltungen dieser Makromoleküle entschlüsseln. Tatsächlich zeigt die dreidimensionale Architektur der MHETase einige Besonderheiten: Enzyme wie die MHETase, binden zunächst an ihr Zielmolekül, bevor eine chemische Reaktion eintritt. Für jedes abzubauende Molekül braucht man ein maßgeschneidertes Enzym: „Wir können jetzt genau lokalisieren, an welchen Stellen das MHET-Molekül an die MHETase andockt und wie es dadurch in seine beiden Bestandteile Terephthalsäure und Ethylenglykol gespalten wird“, berichtet Dr. Weber.
Allerdings sind PETase und MHETase aktuell noch nicht besonders effizient. „Kunststoffe gibt es erst seit wenigen Jahrzehnten in diesem Ausmaß – selbst Bakterien mit ihrer schnellen Generationenfolge und raschen Anpassungsfähigkeit schaffen es nicht in einer so kurzen Zeit, durch den evolutionären Prozess von Versuch und Irrtum eine perfekte Lösung zu entwickeln“, erklärt Weber. „Nachdem wir die Struktur dieses sehr wichtigen Enzyms aufklären konnten, können wir nun auch Varianten planen, herstellen und biochemisch charakterisieren, die deutlich höhere Aktivität als die natürliche MHETase zeigen und sogar gegenüber einem weiteren Zwischenprodukt des PET Abbaus, BHET, aktiv sind“, ergänzt Prof. Bornscheuer.
Perspektivisch will Prof. Bornscheuer daher daran arbeiten, PETase und MHETase systematisch für ihre Aufgabe, die Zerlegung von PET, zu optimieren. Gert Weber plant, diese Studien durch weitere strukturbiologische Arbeiten zu ergänzen, um die plastikverdauenden Enzyme schrittweise hin zur Anwendung zu bringen. Dazu ist der Zugang zu den Messstationen und der IT-Infrastruktur des HZB unerlässlich.
Diese Arbeit weist einen Weg hin zu einem „perfekten Recycling“: Künftig könnten solche optimierten Enzyme in biotechnologischen geschlossenen Kreisläufen produziert werden, um PET-Kunststoffe und (perspektivisch) auch weitere Polymere wirklich in ihre Grundbausteine zu zerlegen. Die Kunststoffproduktion wäre dann – Mülltrennung vorausgesetzt – ein geschlossener Kreislauf und nicht mehr vom Rohöl abhängig. Ein Teil des Plastik-Müllproblems wäre damit lösbar.
„Damit man in der Struktur sieht, wie das Enzym an PET bindet und es zersetzt, benötigt man ein Plastikfragment, das an MHETase bindet, aber nicht gespalten wird“, erklärt Dr. Weber. Ein Mitarbeiter aus dem damaligen Arbeitskreis Weber an der Universität Greifswald, Dr. Gottfried Palm, zerschnitt dafür eine PET-Flasche, zersetzte das PET chemisch und synthetisierte daraus ein kleines Plastikfragment, das an MHETase binden, aber von dieser nicht mehr gespalten werden kann. Aus dieser ‚blockierten‘ MHETase wurden dann am HZB winzige Kristalle für die Strukturuntersuchungen gezüchtet. „Durch diese Strukturuntersuchungen können wir der MHETase gewissermaßen ‚bei der Arbeit zuschauen‘ und daraus Strategien entwickeln, das Enzym zu optimieren“, erläutert Dr. Weber.
„Durch die gemeinsame Forschungsgruppe haben wir an BESSY II die Möglichkeit, jederzeit sehr rasch an den viel gebuchten MX-Beamlines Messzeit anzubieten“, sagt Dr. Manfred Weiss, der für die MX-Beamlines, verantwortlich ist. Die MX-Beamlines (MX steht für Makromolekulare Kristallographie) sind darauf spezialisiert, winzige kristalline Proben aus organischen, sehr großen Molekülen zu durchleuchten, aus den Daten lassen sich die 3D-Faltungen dieser Makromoleküle entschlüsseln. Tatsächlich zeigt die dreidimensionale Architektur der MHETase einige Besonderheiten: Enzyme wie die MHETase, binden zunächst an ihr Zielmolekül, bevor eine chemische Reaktion eintritt. Für jedes abzubauende Molekül braucht man ein maßgeschneidertes Enzym: „Wir können jetzt genau lokalisieren, an welchen Stellen das MHET-Molekül an die MHETase andockt und wie es dadurch in seine beiden Bestandteile Terephthalsäure und Ethylenglykol gespalten wird“, berichtet Dr. Weber.
Allerdings sind PETase und MHETase aktuell noch nicht besonders effizient. „Kunststoffe gibt es erst seit wenigen Jahrzehnten in diesem Ausmaß – selbst Bakterien mit ihrer schnellen Generationenfolge und raschen Anpassungsfähigkeit schaffen es nicht in einer so kurzen Zeit, durch den evolutionären Prozess von Versuch und Irrtum eine perfekte Lösung zu entwickeln“, erklärt Weber. „Nachdem wir die Struktur dieses sehr wichtigen Enzyms aufklären konnten, können wir nun auch Varianten planen, herstellen und biochemisch charakterisieren, die deutlich höhere Aktivität als die natürliche MHETase zeigen und sogar gegenüber einem weiteren Zwischenprodukt des PET Abbaus, BHET, aktiv sind“, ergänzt Prof. Bornscheuer.
Perspektivisch will Prof. Bornscheuer daher daran arbeiten, PETase und MHETase systematisch für ihre Aufgabe, die Zerlegung von PET, zu optimieren. Gert Weber plant, diese Studien durch weitere strukturbiologische Arbeiten zu ergänzen, um die plastikverdauenden Enzyme schrittweise hin zur Anwendung zu bringen. Dazu ist der Zugang zu den Messstationen und der IT-Infrastruktur des HZB unerlässlich.
Diese Arbeit weist einen Weg hin zu einem „perfekten Recycling“: Künftig könnten solche optimierten Enzyme in biotechnologischen geschlossenen Kreisläufen produziert werden, um PET-Kunststoffe und (perspektivisch) auch weitere Polymere wirklich in ihre Grundbausteine zu zerlegen. Die Kunststoffproduktion wäre dann – Mülltrennung vorausgesetzt – ein geschlossener Kreislauf und nicht mehr vom Rohöl abhängig. Ein Teil des Plastik-Müllproblems wäre damit lösbar.
Diese Newsmeldung wurde via Informationsdienst Wissenschaft erstellt.