Vitamin A
- Wikipedia:Vorlagenfehler/Vorlage:Cite journal/temporär
- Vitamin
- Polyen
- Cyclohexen
- Retinoid
- Arzneistoff
Vitamin A bezeichnet mehrere chemische Verbindungen, die in allen Tieren biologische Funktionen haben. Sie werden teilweise direkt mit der Nahrung aufgenommen oder aus Carotinen (Provitamin A) gebildet, wozu nicht alle Tiere in der Lage sind (z. B. Hauskatzen).[1]
Beim Mensch zählt man Retinal, Retinol, Retinsäuren und Retinylpalmitat als Vitamin A, sowie 3-Dehydroretinol einschließlich des Aldehyds. Sie können durch enzymatisch katalysierte Reaktionen ineinander übergeführt werden, mit der einzigen Ausnahme, dass Retinsäuren nicht mehr recycliert werden können. Chemisch handelt es sich um Retinoide. Sind nicht genug davon im Körper vorhanden, entsteht eine Hypovitaminose (siehe unten).
Geschichte
Bereits um 1500 v. Chr. verwendeten die Chinesen Leber und Honig zur Heilung von Nachtblindheit. Im 16. Jahrhundert n. Chr. beschrieb Guilleaume diese Heilung.
Vorkommen
In tierischen Nahrungsmitteln steht Vitamin A hauptsächlich als Retinylpalmitat zur Verfügung, in pflanzlichen als Carotine.
Zunächst der Vitamin-A-Gehalt ausgewählter Lebensmittel (vor allem tierischer Herkunft), gemessen in/umgerechnet auf µg Retinoläquivalent/100 g:[2]
| Nahrungsmittel | Herkunft | Retinoläquivalent µg/100 g |
|---|---|---|
| Rindsleber | tierisch | 7744 |
| Leberwurst | tierisch | 4220 |
| Hühnerleber | tierisch | 3980 |
| Süßkartoffel | pflanzlich | (0 -) 1000 |
| Karottensaft | pflanzlich | 950 |
| Karotten, roh | pflanzlich | (800 -) 850 |
| Karotten, gekocht | pflanzlich | (500 -) 800 |
| Kürbis in Dosen | pflanzlich | 780 |
| Grünkohl, gekocht/gefroren | pflanzlich | 730 |
| Butter | tierisch | 680 |
| Frühstücksflocken | pflanzlich | (300 -) 500 |
| Spinat, roh | pflanzlich | 470 |
| Markstammkohlblätter, gekocht | pflanzlich | 400 |
| Eigelb | tierisch | 380 |
| Löwenzahnblätter, gekocht | pflanzlich | 300 |
| Kürbis, gekocht | pflanzlich | 250 |
| Aprikosen, roh/getrocknet | pflanzlich | (100 -) 200 |
| Cantaloupe-Melone, roh | pflanzlich | 170 |
| Ei, ganz | tierisch | 140 |
| Aprikose, in Dosen | pflanzlich | (60 -) 80 |
| Kondensmilch | tierisch | 74 |
| Lachs, je nach Zubereitung | tierisch | (17 -) 64 |
| Milch | tierisch | 46 |
| Mango, roh | pflanzlich | 40 |
| Hühnerfleisch | tierisch | (5 -) 25 |
| Pfirsich, roh | pflanzlich | (15 -) 20 |
| Buttermilch, fettarm | tierisch | 14 |
| Dorsch, roh | tierisch | 14 |
| Dorsch, gebraten | tierisch | 10 |
| Schweinefleisch nach Zub. | tierisch | (0 -) 10 |
| Rindfleisch | tierisch | 0 |
| Sojamilch | pflanzlich | 0 |
| Erdnussbutter | pflanzlich | 0 |
Der Körper kann überschüssiges Vitamin A kaum abbauen, weshalb es sich leicht im Körper, insb. in der Leber anreichert. Von häufigem Konsum von Leber ist deshalb abzuraten. Schweineleber enthält beispielsweise bis zu 42 mg Vitamin A (140.000 IE) pro 100 g. In diesem Kontext ist anzumerken, dass die Leber des Eisbären (Ursus maritimus) aufgrund ihres sehr hohen Vitamin-A-Gehaltes toxisch ist und deshalb von den Inuit nicht gegessen wird. Dies trifft in geringerem Maße auch für andere Tiere der Arktis, speziell verschiedene Robben, zu.[3]
Durch die Umrechnung auf Retinoläquivalent (RAE) können nun die Carotingehalte pflanzlicher Nahrungsmittel mit tierischen Nahrungsmitteln verglichen werden. Zu diesem Zweck eine Tabelle ausgewählter pflanzlicher Lebensmittel, gemessen in/umgerechnet auf µg Retinoläquivalent/100 g:[2]
Überschüssige Carotine haben keine direkt giftige Wirkung. Es mehren sich aber die Hinweise auf ein erhöhtes Krebsrisiko, insbesondere bei Rauchern.
Physiologie
Provitamin A (Carotine), Retinylpalmitat und Retinol werden mit der Nahrung aufgenommen. Retinylpalmitat wird durch die Pankreaslipase zu Retinol hydrolysiert. Obwohl die Carotine in den meisten Gewebetypen zu Vitamin A umgesetzt werden können, findet der Großteil dieser Umwandlung in Darmzellen statt. Das entstehende Retinal und auch Retinol werden im Zytosol von zytosolischen retinol-bindenden Proteinen (CRBP I bis III) aufgenommen, wiederum zu Retinylpalmitat umgesetzt und mithilfe von Chylomikronen zur Leber verfrachtet. Von dort werden sie im Plasma mithilfe des Plasma-RBP transportiert. Den Empfang an der Zielzelle erleichtert der RBP-Rezeptor. Im Gewebe kann Retinol/Retinal als Retinylpalmitat zwischengespeichert werden; dies ist auch die Speicherform, in der das meiste Vitamin A in der Leber vorliegt.[4]
Aufschluss und Aufnahme von Vitamin A
Retinylpalmitat und Retinol werden mit tierischer Nahrung aufgenommen. Retinal und Retinsäure spielen dagegen keine Rolle bei der Ernährung. In jedem Fall handelt es sich um lipophile Verbindungen, die sich zusammen mit anderen Lipiden im Darm sammeln. Retinol bindet direkt an die Zellmembran von Enterozyten, Retinylpalmitat wird vorher mithilfe des Enzyms Pankreaslipase in Retinol und Palmitat aufgespalten:
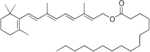 + H2O $ \longrightarrow $
+ H2O $ \longrightarrow $ +
+ H+
Da Retinol an das sich im Zellinnern befindende retinol-bindende Protein CRBP II stärker bindet als an die Membran, bleibt Retinol nicht lange in der Membran und bewegt sich ins Zytosol.[5]
Umwandlung der Carotine
Neben β-Carotin nehmen Tier und Mensch pflanzliches α-Carotin und β-Cryptoxanthin mit der Nahrung auf. Das Enzym β-Carotin-15,15′-Monooxygenase (BMO) ist in der Lage, diese Carotine zu Retinal umzusetzen, wobei nur bei β-Carotin diese Umsetzung zu zwei Molekülen Retinal vollständig geschieht, während die anderen Stoffe asymmetrisch gespalten werden und jeweils nur ein Molekül Retinal entsteht.
β-Carotin wird in zwei Moleküle all-trans-Retinal gespalten. BMO wird in vielen Gewebetypen exprimiert, am meisten Aktivität herrscht aufgrund der Substratverfügbarkeit jedoch im Darm.[6]
Auch das Retinal aus dieser Reaktion bindet schnell an CRBP II im Zellinnern der Enterozyten. Ist der Vitamin-A-Bedarf gestillt, wird die BCMO1-Genexpression zurückgefahren. Überschüssiges β-Carotin lokalisiert in lipophilen Zonen des Körpers, so auch in der Haut, was im Extremfall als harmlose Gelbfärbung wahrnehmbar ist (Aurantiasis cutis, Karotinämie).[7]
Retinal wird anschließend zu Retinol reduziert, wahrscheinlich von einem Enzym, das in der Membran des ER (dem Zytosol zugewandt) lokalisiert ist, der Retinal-Reduktase RalR1.[6]
Veresterung und Transport in die Leber
Nicht benötigtes Retinol wird in vielen Gewebetypen zu Retinylpalmitat verestert, katalysierendes Enzym ist die Lecithin-Retinol-Acyltransferase:
+
$ \longrightarrow $
$ \longrightarrow $  +
+
All-trans-Retinol und Dipalmitoyllecithin werden zu Retinylpalmitat und 2-Palmitoyllecithin umgesetzt. Die Lecithine werden der ER-Membran entnommen, in deren Nähe die Reaktion stattfindet.[8]
Zum Einbau in Chylomikronen ist nun das mikrosomale Triglycerid-Transferprotein notwendig. Es ist nicht bekannt, wie viele Moleküle Retinylpalmitat sich letztendlich in einem Chylomikron auf den Weg machen, der zunächst durch die Lymphe und dann ins Blutplasma führt. Da keine Transferproteine für Retinylpalmitat bekannt sind, bleibt dieses bis zur Leber in Chylomikronen. Deren dortiger Abbau im Endothel von Leberparenchymzellen durch Lipoproteinlipase und die sofortige Hydrolyse dort durch eine Retinylesterhydrolase (REH) führt zur Aufnahme von Retinol in das Zytosol von Leberzellen.[4][9]
Funktion
Vitamin A ist wichtig für das Wachstum, Funktion und Aufbau von Haut und Schleimhäuten, Blutkörperchen, Stoffwechsel sowie für den Sehvorgang. Die Verwertung dieses Vitamins im Körper kann durch Leberschäden und die Einnahme von Östrogenpräparaten gestört werden. Neueste Untersuchungen zeigten, dass entgegen der Vermutung selbst durch geringste Mengen Fett in Nahrungsmitteln das Vitamin A vom Körper aufgenommen und verwendet werden kann.
Nervensystem
Retinol erhält gesunde Nervenzellen in den peripheren Nervenbahnen, im Gehirn und im Rückenmark.
Blutkörperchen
Retinol fördert entscheidend die Bildung neuer Erythrozyten und erleichtert den Einbau des Eisens.
Eiweiß-Stoffwechsel
Es ist an der Proteinsynthese und beim Fettstoffwechsel in der Leber beteiligt, so dass eine proteinreiche Nahrung zu einem Vitamin-A-Mangel führen kann. Auch bei erhöhtem Stress erhöht sich der Vitamin-A-Bedarf, da Stress den Proteinbedarf erhöht. Somit steigt der Retinol-Bedarf auch bei schweren Krankheiten wie Arthritis, Aids oder Krebs.
Haut und Schleimhäute
Vitamin A spielt eine zentrale Rolle für die Struktur und Gesundheit dieser Gewebe, da es ein normales Zellwachstum nicht nur der Haut, sondern auch der Wände der Atem-, Verdauungs- und Harnwege gewährleistet. Des Weiteren beugt es DNA-Schäden in Hautzellen vor, trägt zu deren Reparatur bei und normalisiert die Hautfunktionen, beispielsweise gesunde Zellteilung der Keratinozyten (→ Epidermis).
Knochengerüst
Vitamin A ist auch am Aufbau und Wachstum von Knochen sowie der Heilung nach Brüchen von Bedeutung. Besonders bei Kindern ist daher eine ausreichende Vitamin-A-Versorgung wichtig.
embryonales Wachstum
Die Vitamin-A-Säure (All-trans-Retinsäure) bzw. ihr Salz, das Retinat, ist ein wichtiger Wachstumsfaktor für Nervenzellen während der Embryonalentwicklung. Es wird von Zellen des Primitivknotens ausgeschüttet und ist beteiligt an der Ausbildung der Längsachse (vorn-hinten-Orientierung) des Embryos. Nervenzellen wandern entlang des Konzentrationsgradienten der Retinsäure.
Reproduktion
Retinol ist an der Synthese von Testosteron und Östrogen, sowie an der Spermato- und Oogenese beteiligt. Des Weiteren ist die Menge und Form der Spermien von einer optimalen Versorgung mit Vitamin A abhängig. Über die Wirkungen auf die menschlichen Schleimhäute ist Vitamin A auch für die Aufrechterhaltung der Struktur und Funktion der Samen- und Eileiter (beide mit Schleimhaut ausgekleidet) wichtig. Bei der Frau werden Unfruchtbarkeit und Fehlgeburten mit Retinolmangel in Zusammenhang gebracht.
Immunsystem
Zum einen erhöht Retinol die Widerstandsfähigkeit gegenüber Infektionen, da, wie bereits erwähnt, Vitamin A Haut und Schleimhäute gesund hält und somit wirkungsvolle Barrieren gegen Bakterien, Viren und Parasiten unterstützt. Des Weiteren erhöhen Retinol und Beta-Carotin Wirksamkeit und Zahl der weißen Blutkörperchen und erleichtern zusätzlich die Produktion von Antikörpern. Schon ein leichter Mangel erhöht das Risiko, an Lungenentzündung zu erkranken oder Durchfall zu bekommen, um das Zwei- bis Dreifache.
Bedarf
Der tatsächliche Tagesbedarf ist abhängig von Alter, Geschlecht und Lebensumständen. Erwachsene sollten im Durchschnitt 0,8 bis 1,0 mg (= 2.600–3.300 IE) täglich aufnehmen, wobei Männer gegenüber Frauen einen leicht erhöhten Bedarf haben. Längeres Kochen, Sauerstoff und Licht schaden Vitamin A. Deshalb sollte man Lebensmittel, die Vitamin A enthalten, immer ungeschält oder verpackt und dunkel – am besten im Kühlschrank – lagern. Die Kochverluste liegen zwischen 10 und 30 Prozent.
Hypovitaminose
Bei Mangel an Vitamin A kommt es zu erhöhter Infektionsanfälligkeit, Trockenheit der Haut, Haare, Nägel und Augen, Haarausfall, Nachtblindheit, verringerter Sehschärfe, erhöhter Lichtempfindlichkeit, Eisenmangel, erhöhter Gefahr einer arteriosklerotischen Herzerkrankung, erhöhtem Krebsrisiko in Organen mit Schleimhäuten, erhöhtem Risiko für Nierensteine aufgrund erhöhter Calciumausscheidung, Fruchtbarkeitsstörungen, beeinträchtigtem Geruchssinn, Tastsinn und Appetit, Müdigkeit und Wachstumsstörungen wie z. B. Störungen des Knochenwachstums im Kindesalter.
Ursachen einer Hypovitaminose
- Entzündungen, Operationen, aber auch Stress
- Rauchen und ständiges Einatmen schlechter Luft
- Umweltgifte wie z. B. Cadmium
- Starkes Sonnenlicht (z. B. am Strand oder im Schnee), besonders bei hellhäutigen Menschen
- Störungen der Fettresorption, meist wegen Problemen mit Leber, Gallenblase oder Bauchspeicheldrüse
- Jeder fünfte Europäer nimmt nicht genug Retinol über die Nahrung auf. Besonders bei Kindern entsteht schnell eine Unterversorgung, da sie geringere Speichermöglichkeiten besitzen, jedoch einen hohen Bedarf haben.
- Alkohol beeinträchtigt die Aufnahme, Speicherung und Mobilisierung
- Diabetiker und Menschen mit Schilddrüsenüberfunktion können die pflanzlichen Carotinoide nur schlecht in Vitamin A umwandeln.
- Cholesterinsenkende Mittel und Abführmittel verschlechtern die Aufnahme
- Bestimmte Schlafmittel verbrauchen Speichervorräte in der Leber
Die Unterversorgung mit Vitamin A (Vitamin-A-Defizienz oder VAD) ist ein weit verbreitetes Problem in Entwicklungsländern. Etwa 250 Millionen Vorschulkinder leiden an VAD und jedes Jahr sterben daran etwa eine Million Kinder. Zwischen 250.000 und 500.000 Kinder erblinden zudem durch VAD und die Hälfte stirbt im darauf folgenden Jahr.[10] Auch führt Vitamin-A-Mangel zu einer stark erhöhten Komplikationsrate bei Infektionskrankheiten wie Masern.[11]
Bekämpfung
Zur Bekämpfung der Vitamin-A-Defizienz existieren mehrere Strategien:[12]
- Verteilung von Vitamintabletten: Hierbei werden typischerweise alle 6 Monate Retinoltabletten verabreicht. Das Retinol wird in der Leber gespeichert und von dort über einen Zeitraum von vier bis sechs Monaten abgegeben. Diese Strategie ist kosteneffektiv, es kann jedoch Schwierigkeiten geben, große Anteile der bedürftigen Kinder zu erreichen.
- Anreicherung von Lebensmitteln: Hierbei werden Lebensmittel während der Herstellung oder Verpackung mit Mikronährstoffen angereichert. In Lateinamerika konnte beispielsweise die Anreicherung von Zucker erheblich zur Bekämpfung der VAD beitragen. Allerdings ist die Anreicherung nur eine Option, wenn die Bedürftigen industriell verarbeitete Produkte konsumieren. In Afrika ist dies z. B. oft nicht der Fall.
- Diversifizierung der Ernährung: Maßnahmen wie Aufklärung unter Betroffenen sollen helfen, dass mehr vitamin-A-reiche Lebensmittel konsumiert werden, etwa aus dem eigenen Garten. Der Nachteil ist, dass die Verfügbarkeit von vitamin-A-reichen Nahrungsmitteln häufig saisonal bedingt stark schwankt.
- Biofortifikation: Hierbei wird mithilfe der Pflanzenzüchtung der Mikronährstoffgehalt von Nutzpflanzen erhöht. So wurde der Gehalt von Provitamin A, Zink oder Eisen in Grundnahrungsmitteln wie Maniok, Mais, Reis und Süßkartoffel erhöht, auch mithilfe der Gentechnik (Goldener Reis). Schätzungen zufolge ist die Kosteneffizienz der Biofortifikation in Entwicklungsländern relativ hoch.
Hypervitaminose
Im Gegensatz zu den Retinoiden kommen Vergiftungen mit Carotinen nicht vor, da ein Überangebot den Körper veranlasst, die Umwandlung zu Vitamin A herunterzufahren. Ein Zuviel an Carotinen macht sich optisch als Gelbfärbung der Haut bemerkbar (Carotinämie, "Karottenikterus"), ist aber nicht behandlungsbedürftig, da keine Hypervitaminose vorliegt.
Eine (längere) Überversorgung mit über 15 mg (= 50.000 IE) Vitamin A kann im Gegensatz dazu zu Erbrechen, Durchfall, Kopfschmerzen, erhöhtem Hirndruck (Pseudotumor cerebri), Abnahme der Knochengewebsdichte (Osteoporose), Vergrößerung von Leber und Milz, Verringerung der Schilddrüsentätigkeit und schmerzhaften Wucherungen der Knochenhaut führen. Generell können höhere Einmaldosen als unbedenklich angesehen werden, während wiederholt höhere Dosen eher die Gefahr einer Intoxikation in sich tragen. Für Tagesdosen von mehr als 7,5 mg (= 25.000 IE) wurden eine Reihe lebertoxischer Effekte nach mehrjähriger Zufuhr beschrieben, teilweise mit Todesfolge.[13]
Eine einzelne Studie, die teratogene (=fruchtschädigende) Eigenschaften bei der Aufnahme von 30.000 IE Vitamin A zeigte, konnte nicht bestätigt werden. Die Sicherheit einer Dosis von 10.000 IE wurde mehrfach gezeigt. Die Empfehlung einer täglichen Dosis von 2.500 IE (0,75 mg) scheint damit gerechtfertigt.[14][15]
Finnische und amerikanische Studien (ATBC-Studie in Finnland und die CARET-Studie in den USA) haben eine starke Erhöhung des ohnehin hohen Lungenkrebsrisikos bei Rauchern unter Gabe von β-Carotin (teilweise mit Vitamin A und E gemischt) festgestellt. Eine Kombination stark Vitamin A- und E-haltiger Nahrungsergänzungsmittel oder Nahrungsmittel zusammen mit Tabakgenuss sollte deshalb vermieden werden.[16][17]
Diagnostik
Der Serumspiegel ist zur Diagnose einer Hypervitaminose ungeeignet. Ein sicherer Indikator ist hingegen die Relation von Vitamin A zu RBP (Retinol-bindendes Protein). Übersteigt der Serumspiegel die Bindungskapazität durch RBPs, so liegt freies Vitamin A vor, das toxische Wirkung entfaltet.
Einzelnachweise
- ↑ Schweigert FJ, Raila J, Wichert B, Kienzle E: Cats absorb beta-carotene, but it is not converted to vitamin A. In: J. Nutr. 132. Jahrgang, 6 Suppl 2, Juni 2002, S. 1610S–2S, PMID 12042471.
- ↑ 2,0 2,1 Vitamin A, RAE(μg) Content of Selected Foods per Common Measure, sorted alphabetically. In: U.S. Department of Agriculture, Agricultural Research Service, USDA Nutrient Data Laboratory (Hrsg.): USDA National Nutrient Database for Standard Reference, Release 22. 2009 (usda.gov [abgerufen am 28. September 2010]).
- ↑ Dietrich Mebs: Gifttiere – Ein Handbuch für Biologen, Toxikologen, Ärzte und Apotheker. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 1992; Seite 128, ISBN 3-8047-1219-3.
- ↑ 4,0 4,1 Blomhoff R, Green MH, Green JB, Berg T, Norum KR: Vitamin A metabolism: new perspectives on absorption, transport, and storage. In: Physiol. Rev. 71. Jahrgang, Nr. 4, Oktober 1991, S. 951–90, PMID 1924551.
- ↑ Harrison EH, Hussain MM: Mechanisms involved in the intestinal digestion and absorption of dietary vitamin A. In: J. Nutr. 131. Jahrgang, Nr. 5, Mai 2001, S. 1405–8, PMID 11340090.
- ↑ 6,0 6,1 Fierce Y, de Morais Vieira M, Piantedosi R, Wyss A, Blaner WS, Paik J: In vitro and in vivo characterization of retinoid synthesis from beta-carotene. In: Arch. Biochem. Biophys. 472. Jahrgang, Nr. 2, April 2008, S. 126–38, doi:10.1016/j.abb.2008.02.010, PMID 18295589, PMC 2587144 (freier Volltext).
- ↑ Peter Altmeyer, M. Bacharach-Buhles, N. Buhles, Neal H. Brockmeyer, M. Herde, M. Stucker: Springer Enzyklopädie Dermatologie, Allergologie, Umweltmedizin. Springer, ISBN 3-540-41361-8, S. 165–166.
- ↑ Ruiz A, Winston A, Lim YH, Gilbert BA, Rando RR, Bok D: Molecular and biochemical characterization of lecithin retinol acyltransferase. In: J. Biol. Chem. 274. Jahrgang, Nr. 6, Februar 1999, S. 3834–41, PMID 9920938.
- ↑ Nayak N, Harrison EH, Hussain MM: Retinyl ester secretion by intestinal cells: a specific and regulated process dependent on assembly and secretion of chylomicrons. In: J. Lipid Res. 42. Jahrgang, Nr. 2, Februar 2001, S. 272–80, PMID 11181758.
- ↑ Micronutrient deficiencies, WHO, 2011.
- ↑ Traoré, L., et al.: Strategies to control vitamin A deficiency. Sante 1998, 8 (2): 158-162.
- ↑ Hugo De Groote, Simon Chege Kimenju, Ulrich B. Morawetz (2011): Estimating consumer willingness to pay for food quality with experimental auctions: the case of yellow versus fortified maize meal in Kenya. Agricultural Economics, Band 42, S. 1–16.
- ↑ Anonym: Vitamin A: Toxicity from Supplements In: Medical Sciences Bulletin 1995; Pharmaceutical Information Associates, Ltd.
- ↑ Hartmann S, Brørs O, Bock J, et al.: Exposure to retinyl esters, retinol, and retinoic acids in non-pregnant women following increasing single and repeated oral doses of vitamin A. In: Ann. Nutr. Metab. 49. Jahrgang, Nr. 3, 2005, S. 155–64, doi:10.1159/000086879, PMID 16006784.
- ↑ Miller RK, Hendrickx AG, Mills JL, Hummler H, Wiegand UW: Periconceptional vitamin A use: how much is teratogenic? In: Reprod. Toxicol. 12. Jahrgang, Nr. 1, 1998, S. 75–88, PMID 9431575.
- ↑ D. Albanes, O. P. Heinonen u.a.: Alpha-Tocopherol and beta-carotene supplements and lung cancer incidence in the alpha-tocopherol, beta-carotene cancer prevention study: effects of base-line characteristics and study compliance. In: Journal of the National Cancer Institute. Band 88, Nummer 21, November 1996, S. 1560–1570, ISSN 0027-8874. PMID 8901854.
- ↑ G. E. Goodman, M. D. Thornquist u.a.: The Beta-Carotene and Retinol Efficacy Trial: incidence of lung cancer and cardiovascular disease mortality during 6-year follow-up after stopping beta-carotene and retinol supplements. In: Journal of the National Cancer Institute. Band 96, Nummer 23, Dezember 2004, S. 1743–1750, ISSN 1460-2105. doi:10.1093/jnci/djh320. PMID 15572756.
