Sumpfweihe
- Seiten, die Referenzierungsfehler enthalten
- Seiten mit Skriptfehlern
- Wikipedia:Exzellent
- Weihen
- Mythologie der Māori
- Mythologie der Aborigines
- Wikipedia:Artikel-Feedback/Zusätzliche Artikel
| Sumpfweihe | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

Sumpfweihe (C. approximans gouldi) ♂ | ||||||||||
| Systematik | ||||||||||
| ||||||||||
| Wissenschaftlicher Name | ||||||||||
| Circus approximans | ||||||||||
| (Peale, 1848) |
Die Sumpfweihe (Circus approximans) ist ein Greifvogel aus der Familie der Habichtartigen und der Gattung der Weihen.
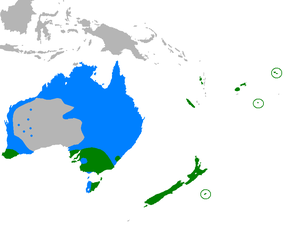
Die braun-weiße Sumpfweihe ist eine der größten Vertreterinnen ihrer Gattung und ernährt sich vor allem von Nagetieren, Hasenartigen und Vögeln, häufig auch von Aas. Das stark disjunkte Verbreitungsgebiet umfasst Teile Australiens, Tasmanien, Neuseeland, sowie die Inseln des südlichen Ozeaniens. Mit Ausnahme von Australien und Tasmanien ist die Sumpfweihe ein Standvogel. Sie bewohnt Feuchtgebiete wie Marschen, Sümpfe und Flussufer, aber auch Weiden und Getreidefelder.
Vor allem in Neuseeland, wo sie der größte Greifvogel ist, hat sich die Sumpfweihe von einer klassischen Vertreterin ihrer Gattung hin zu einem vorrangigen Verwerter von Aas entwickelt.[1][2] Auch wegen ihres kräftigen Körperbaus, der ihr den für Weihen sonst typischen Gaukelflug erschwert, ähnelt sie in Ernährung und Jagdverhalten oft eher Bussarden als anderen Weihen.
In der Mythologie der Māori wird die Sumpfweihe als Kāhu bezeichnet. Sie hat in den Erzählungen der neuseeländischen Ureingeborenen die Rolle eines Götterboten inne. Die Überlieferungen der Aborigines kennen sie unter dem Namen Joongabilbil als Überbringer des Feuers.
Merkmale
Aussehen und Körperbau
Die Sumpfweihe ist eine sehr große und kräftige Weihe und zeigt, wie auch andere Weihen, einen ausgeprägten Geschlechtsdimorphismus hinsichtlich Größe und Färbung.
Die Flügellänge adulter Männchen der Nominatform C. approximans approximans liegt bei 392–415 mm, die Schwanzlänge bei 207–250 mm und der Tarsus wird 87–105 mm lang. Männchen wiegen 392 bis 726 g. Weibchen sind im Durchschnitt bis zu 20 % größer und 30 % schwerer. Ihre Flügellänge beträgt 418–430 mm, und auch ihr Schwanz ist mit 215–263 mm etwas länger, während der Tarsus die gleiche Länge wie beim männlichen Vogel hat. Weibchen wiegen 622–1100 g. Damit ist die Sumpfweihe eine der schwersten und größten Arten der Gattung.[3][4]
Männchen der Nominatform sind auf der Oberseite braun mit hellen, rötlichen Federsäumen. Kopf und Hals sind etwas heller als der Rücken und gestrichelt. Die Handschwingen wie auch die Steuerfedern sind verwaschen grau gefärbt und mit einer dünnen, schwarzen Bänderung versehen. Die Unterseite der Hand- und Armschwingen zeigt ein ähnliches, helleres Farbmuster, jedoch mit einem weißen Bereich an der Basis der Handschwingen. Bauch und Brust sind beim Männchen weiß oder cremefarben; sie weisen eine rötliche Strichelung auf, die zur Kehle und Brust hin dichter wird, sich aber zum weißen Bürzel hin verliert. Die Weibchen zeigen eine sehr ähnliche Gefiederzeichnung. Insgesamt sind sie jedoch dunkler gefärbt: Bänderungen treten deutlich hervor, auch geht die Oberseite stärker ins Dunkelbraune. Das verwaschene Grau des Männchens ist beim Weibchen eher graubraun; zudem ist die Unterseite sehr viel dichter und durchgehender gestrichelt.[5]
Die Sumpfweihe verfügt über einen für Weihen typischen Gesichtsschleier, der sich durch seine dunkelbraune Farbe und einen Kranz heller Federn vom Rest des Kopf- und Kehlgefieders abhebt. Die Beine adulter Vögel sind gelb, ebenso die Wachshaut und die Augenringe; einige männliche Vögel zeigen an den Beinen jedoch auch eine orange Färbung.[5]
Juvenilen Vögeln fehlen vor allem die hellen Anteile im Gefieder adulter Sumpfweihen. Lediglich die weißlich-cremefarbenen Flächen an der Basis der Handschwingen sind bereits vorhanden, und im Nacken bilden weiße Sprenkel oder Strichel einen hellen Kragen. Die Farbe der Körperunterseite bewegt sich zwischen dunkel- und rotbraun und weist bereits die Grundstruktur der Strichelung bei ausgefärbten Tieren auf. Während auch bei juvenilen Sumpfweihen Wachshaut und Beine gelb sind, besitzen sie anfangs noch braune Augenringe. Beim Männchen hellen sich diese relativ schnell auf, sodass sie im dritten Jahr gelb sind. Bei weiblichen Tieren dauert dieser Prozess deutlich länger und ist mitunter erst nach dem vierten Lebensjahr abgeschlossen. Juvenile Sumpfweihen zeigen in der Färbung keine Unterschiede, zweijährige (immature) ähneln äußerlich stark den Weibchen, was die Bestimmung des Geschlechts erschwert.[6][7]
Das Daunenkleid der Küken der Sumpfweihe ist auf der Körperunterseite weiß bis beige; auf der oberseite ist es dunkler. Die dunkelbraunen Federn erscheinen zunächst an den Schultern, den Flügeln und am Schwanz. Schnabel und Beine sind bereits gelb. Frisch flügge gewordene Vögel zeigen oft rötliche Anteile im Gefieder, die sich als unregelmäßiger Saum auf die Steuerfedern und die Hand- und Armschwingen verteilen. Bisweilen finden sich auch noch Reste des weißen Daunenkleides am Bauch.[8]
Mauser
Die erste Mauser ins Federkleid adulter Vögel findet bei juvenilen Sumpfweihen zwischen April und September statt. Von April bis Juli wird dabei nur das Körpergefieder ausgewechselt, im Anschluss werfen die Vögel von August bis November die mittleren Steuerfedern ab. Die erste postnuptiale Mauser dauert fünf Monate findet bei juvenilen Vögeln zwischen November und Ende März (Weibchen), beziehungsweise einen Monat später (Männchen) von Dezember bis Ende April statt. Dabei werden die mittleren Steuerfedern als letztes abgeworfen; Männchen erhalten durch diese Mauser die typische Unterflügelzeichnung.[9]
Bei adulten Weibchen beginnt die postnuptiale Mauser im Dezember, zu diesem Zeitpunkt sind die Jungen etwa eine Woche alt. Die Mauser dauert rund sechs Monate bis Ende Mai. Auch hier findet die Mauser der Männchen um einen Monat versetzt statt, weil das Männchen die Versorgung von Weibchen und Jungen übernimmt. Anders als bei juvenilen Vögeln werden bei adulten Sumpfweihen die mittleren Steuerfedern zuerst abgeworfen. Die Handschwingen werden von innen nach außen ausgewechselt.[9]
Flugbild
Die Sumpfweihe ist ein Greifvogel mittlerer Größe, für eine Weihe ist sie jedoch relativ groß und kräftig gebaut. Dies ist auch beim Flugbild deutlich erkennbar. Während die Flügellast bei den meisten Weihen bei 0,2–0,3 g/cm³ liegt, beträgt sie bei männlichen Sumpfweihen 0,39 g/cm², bei weiblichen sogar 0,41 g/cm². Dadurch fällt es der Sumpfweihe schwerer, wie andere Weihen im tiefen Gaukelflug über dem Boden zu gleiten. Stattdessen kreist sie, ähnlich wie Bussarde, oft 20–100 m über dem Boden. Charakteristisch für die Sumpfweihe sind ruhige, kraftvolle Flügelschläge, die immer wieder von Phasen des Gleitflugs unterbrochen werden. Dabei nehmen die Flügel der Sumpfweihe die für alle Vögel dieser Gattung typische V-Stellung ein. Bisweilen schwenkt oder neigt sie sich im Segelflug zur Seite, häufig lässt die Sumpfweihe im Flug auch die Beine herabhängen.[10][7]
Der tiefe, leicht taumelnde Gaukelflug, nur wenige Meter über dem Erdboden, kommt vor allem dort zum Einsatz, wo sich die Sumpfweihe hauptsächlich von Kleinsäugern ernährt. Dabei nutzt sie den Wind, um lange Strecken über offener Landschaft zurückzulegen und bei Erspähen der Beute plötzlich hinabzutauchen und diese zu greifen.[11][12]
Lautäußerungen
Außerhalb der Brutzeit ist die Sumpfweihe ein akustisch eher unauffälliger Vogel. Die Lautäußerungen lassen sich in verschiedene Kategorien unterteilen und unterscheiden sich je nach Situation: Der Balzruf des Männchens besteht aus einem kurzen, klagenden kii-a, das im hohen Flug ausgestoßen wird. Bei der Inspektion des Nests ist vom Männchen eine Folge von kii-o-Rufen zu hören. Vor der Nahrungsübergabe ruft das Männchen das Weibchen mit einem leisen tschuck-tschuck-tschuck.[13]
Das Weibchen wiederum ruft bei verschiedenen Gelegenheiten mit einem tiefen siiiuh nach dem Männchen, so etwa während der Balz, beim Betteln um Nahrung oder wenn ein Eindringling erscheint, gleiches gilt für bettelnde Junge.[13]
Bei Bedrohung durch Fressfeinde stoßen Sumpfweihen ein lautes, scharfes tschit-tschit-tschit als Drohruf aus. Davon ist der Angstruf, ein lautes tschiiiit zu unterscheiden, der zu hören ist, wenn die Vögel vom Menschen aufgeschreckt oder von Artgenossen mit den Klauen gegriffen werden.[13]
Verbreitung
Das Verbreitungsgebiet der Sumpfweihe umfasst den Südosten und den äußersten Südwesten Australiens, Tasmanien, sowie die Loyalitätsinseln, Neukaledonien, die Wallis-Inseln, Fidschi, Vanuatu und die Chatham-Inseln. Auf den Gesellschaftsinseln wurde die Sumpfweihe eingeführt, ebenso wie 1880 auf Tahiti, wo sie vermutlich das Aussterben der Tahiti-Fruchttaube (Ducula Aurorae) verursacht hat.[14][2] Vereinzelt gibt es auch Berichte über nördlichere Bruten, etwa an der Nordküste von New South Wales oder im nördlichen Queensland.[15][16][7]
In Neuseeland ist die Sumpfweihe wohl erst seit der frühen Neuzeit heimisch und fehlt unter den Funden aus dem frühen Holozän.[17] Dort herrschten seit dem Quartär vor allem Wälder und von Inselgigantismus geprägte Arten wie die Moas, der Haastadler (Harpagornis moorei) und die größere Eyles-Weihe (Circus eylesi) vor. Dies änderte sich erst mit der Ankunft der Maori im 13. Jahrhundert. Diese bejagten die Moas und die Eyles-Weihe, rodeten die Regenwälder und schufen so die Landschaften, die auch heute noch in Neuseeland vorherrschen. In der Folge starben alle großen Vögel Neuseelands aus, sodass die Sumpfweihe (wie auch andere Vögel) eine neue Nische im Ökosystem der Inseln besetzen konnte.[18][17]
Wanderungen
Die Sumpfweihe lebt überwiegend nomadisch und unternimmt, unabhängig von der Jahreszeit, Streifzüge, wobei sie sich vor allem am Nahrungsangebot orientiert. So ist sie auf fast allen Inseln des südlichen Ozeaniens als gelegentlicher Gast anzutreffen. Längere Wanderungen unternimmt sie auch in Neuseeland, wo Sumpfweihen vor allem außerhalb der Brutzeit zwischen Nord- und Südinsel wechseln. Hingegen ist die Sumpfweihe in Tasmanien und Australien ein typischer Zugvogel.[7][19]
Ab Januar, vor allem aber von Juni bis Juli verlässt fast die gesamte Population Tasmanien und die südlichen Brutgebiete und fliegt nordwärts in die Winterquartiere. Diese liegen in New South Wales, entlang der Küste in Queensland und im Northern Territory, in geringerem Umfang auch im Outback und an der Nordwestküste von Western Australia. Gegen Juli kehren die ersten Weihen nach Tasmanien zurück, zwischen Oktober und November erreicht die tasmanische Brutpopulation schließlich ihren Höhepunkt. Die längste bekannte Strecke, die ein Vogel zurücklegte, liegt bei 1520 km (von Tasmanien ins nordöstliche New South Wales), der Durchschnitt liegt bei 260 km bei adulten Tieren. Die australischen Brutgebiete werden während der Brutsaison hauptsächlich von adulten Weihen aufgesucht, juvenile und immature Vögel bleiben während dieser Zeit überwiegend im Inland. Aus Neuseeland werden gelegentlich Sichtungen von Sumpfweihen gemeldet.[7][20][19][21]
In den Winterquartieren im australischen Bundesstaat Victoria ergaben Zählungen einen Vogel alle 0,8–1,7 km².[7]
Lebensraum
Die Sumpfweihe bevorzugt Feuchtgebiete wie Sümpfe, Salzmarschen, Auen und Reisfelder. Im trockenen australischen Binnenland ist sie auch in der Umgebung von Wasserbohrlöchern anzutreffen. Grundsätzlich jagt sie aber in allen Formen von offener Landschaft; so sind Schafweiden in Neuseeland zu einem stark frequentierten Habitat geworden. Auch Heide, Landschaften mit vereinzeltem Baumbewuchs und Getreidefelder dienen der Sumpfweihe als Jagdgrund. Die Sumpfweihe kommt von der Küste bis in Höhen von 1200 m in Australien, 1700 m in Neuseeland sowie 3800 m in Neuguinea vor.[7]
Lebensweise
Jagd und Ernährung
Sumpfweihen jagen im Flug über offenem Gelände. Da sie für Weihen relativ schwer gebaut sind, gehen sie häufiger als andere Vertreter ihrer Gattung dazu über, in großer Höhe über dem Boden zu kreisen und auf erspähte Beute herabzustürzen, statt knapp über der Erde zu gleiten und die Beute in plötzlichem Hinabsinken aus dem Gras zu greifen. Dies hat jedoch zur Folge, dass Sumpfweihen häufig von ihren Beutetieren erspäht werden. Trotz dieses eher für andere Gattungen der Habichtartigen üblichen Verhaltens wählt die Sumpfweihe aber keine hochgelegenen Sitzwarten wie etwa Habichte, sondern nutzt eher „gattungstypische“ Positionen auf Zaunpfosten, Baumstümpfen oder Steinen. Einige Ornithologen wie David Baker-Gabb sind allerdings der Ansicht, dass der hohe Suchflug der Weihe eher dazu dient, nach Aas Ausschau zu halten, da er vor allem dort beobachtet wird, wo die Sumpfweihe sich in hohem Maß von Aas ernährt; auch stößt sie nie aus großer Höhe auf Beute herab, sondern lässt sich erst herabsinken, bevor sie Beute greift.[12] Fische greift die Weihe, indem sie knapp über der Wasseroberfläche fliegt, dann plötzlich herabstößt und den Fisch packt. Diese Jagdweise ist besonders in Fischteichen und anderen Gewässern mit hohem Fischbestand erfolgreich. Der wie ein Schalltrichter wirkende Gesichtsschleier und das erweiterte Mittelohr ermöglichen es der Sumpfweihe, Beute mit einer Genauigkeit von 4° akustisch zu orten. Hat die Sumpfweihe ihre Beute erlegt, trennt sie die Haut mit Mittel- und Hinterklaue auf, frisst zunächst das Fleisch unter der Öffnung und häutet das Beutetier anschließend, um auch an den Rest des Fleisches zu gelangen.[22][23][10][24][25]
Die Sumpfweihe orientiert sich bei ihrer Ernährung stark am jeweiligen Nahrungsangebot. Während im Herbst, Winter und Frühjahr Aas den größten Teil (im Sinne von Biomasse) der Nahrung ausmachen, überwiegt im Sommer Lebendnahrung, da zu dieser Jahreszeit das Angebot an Insekten, Kleinvögeln und Kaninchen am größten ist. Unter den Beutetieren machen Säugetiere, insbesondere Kaninchen und Igel, den größten Teil (ca. 45 %) aus. An zweiter Stelle folgen Vögel (ca. 36 %), vor allem Sperlingsvögel, danach Insekten (ca. 8 %), Eier, meist von Bodennistern (ca. 5 %), sowie Wassertiere (ca. 5 %).[26] Sumpfweihen in Küstennähe passen sich ihrer Umgebung an. So erbeuten sie beispielsweise neben jungen Zwergpinguinen (Eudyptula minor) auch Fische oder Schalentiere.[27][28][24]

Der hohe Anteil von Igeln an der Nahrung lässt sich darauf zurückführen, dass diese häufig während des Winters verhungern und besonders oft Wildunfällen zum Opfer fallen und anschließend von der Sumpfweihe verzehrt werden, gleiches gilt für andere mittelgroße Säuger. Kaninchenaas kann hingegen auch aus Bekämpfungsmaßnahmen gegen diese in Australien und Neuseeland als Schädlinge geltenden Neozoen stammen. In der Regel findet die Sumpfweihe diese Tiere in Kaninchenfallen vor. Unter lebenden Kaninchen werden vorrangig Jungtiere erbeutet, größere Säugetiere werden kaum Opfer der Weihen. Auch unter den geschlagenen Vögeln dominieren kleinere Arten, vor allem Nestlinge; der Großteil der Nahrung wird am Boden erbeutet. Absolute Ausnahmefälle stellen die Erbeutungen von Vögeln dar, die größer als die Weihe sind, etwa eines Weißwangenreihers (Egretta novaehollandiae). Kann die Sumpfweihe zwischen zwei Stücken Aas wählen, entscheidet sie sich in der Regel für das Stück, das sie am leichtesten transportieren kann; es wird anschließend ins Gebüsch gezerrt, wo sie es ungestört fressen kann. Für die in Neuseeland zumindest früher weit verbreitete Meinung, die Sumpfweihe würde auch Lämmer schlagen, findet sich kein Beleg, gleichweg stellen Schafe in Form von Aas für die Vögel in Neuseeland einen bedeutenden Teil der Nahrung dar. Das gilt besonders für die Wintermonate, wenn andere Nahrungsquellen versiegen und der Anteil an Schafsfleisch in der Nahrung auf etwa 80 % steigt.[26][29][30]
Sozialverhalten
Gelegentlich kommt es dazu, dass sich Sumpfweihen zu größeren Verbänden zusammenschließen. Dabei finden sich in Ausnahmefällen bei Dämmerung bis zu 150 Tiere auf einem gemeinsamen Nistplatz zusammen, auf denen die Vögel ovale Schlafnester mit Maßen von etwa 30–36 cm × 20–26 cm anlegen. Zwischen den einzelnen Nestern bilden die Tiere Pfade aus, solange das Gras des Nistplatzes nicht zu hoch ist. Morgens brechen die Weihen dann wieder auf, meist kehrt nur ein Teil zum gemeinsamen Nistplatz zurück. Zumindest für größere Nistgemeinschaften scheint ein erhöhtes Nahrungsangebot ausschlaggebend, etwa nach der Wurfzeit der Kaninchen. Kleinere Verbände von bis zu zehn Tieren können sich aber auch ohne konkreten Anlass zusammenfinden. [31]
Territorialverhalten und Siedlungsdichte
Sumpfweihen besetzen sowohl während der Brutzeit als auch in den Winterquartieren Territorien. Dabei muss zwischen Revieren und Jagdgebieten unterschieden werden: Erstere umfassen mehrere Hektar und werden gegen Eindringlinge verteidigt. Die Jagdgebiete gehen über die Reviergrenzen hinaus und haben eine Fläche von mehreren Quadratkilometern.[32]
Die Reviere werden vom Männchen durch Patrouillenflüge gegenüber potentiellen Rivalen verteidigt. Dabei fliegen beide Männchen langsam im Abstand von etwa 10 m in geringer Höhe mit stark angewinkelten Flügeln und deutlich präsentierten, herabhängenden Beinen entlang der Reviergrenzen. Anschließend fliegen beide in verschiedene Richtungen davon. Eindringlinge werden spätestens ab dem Zeitpunkt der Eiablage angegriffen und davongejagt, wobei sie mit den Klauen angegriffen und bis zu den Grenzen des Reviers verfolgt werden.[32]
Während der Brutsaison teilen sich Männchen und Weibchen ein Revier, dessen Größe stark variieren kann und zudem von den Revieren benachbarter Paare beeinflusst wird. Die beobachteten Reviergrößen liegen zwischen 0,18 und 0,42 km², besonders große Reviere verkleinerten sich nach dem Schlüpfen des Nachwuchses. Diese Reviere werden bis in 20 m Höhe an den Grenzen und 30 m über dem Nest gegen Eindringlinge verteidigt. Die umliegenden Jagdgebiete umfassen eine Fläche von etwa 9 km², von denen ein die inneren 3 km² besonders ausgiebig genutzt werden. Diese Jagdgebiete beinhalten keine fremden Brutreviere, sodass die Vögel keine Angriffe bei der Nahrungssuche zu erwarten haben. Juvenile Sumpfweihen besetzen für gewöhnlich keine Reviere, ihre Jagdgebiete sind folglich größer und weniger ortsgebunden.[32]
Untersuchungen zur Siedlungsdichte ergaben für eine neuseeländisches Gebiet eine Dichte von einem Brutpaar pro 0,5 km². Dabei überschnitten sich Jagdgebiete um bis zu 70 %, die vorrangig genutzten Bereiche jedoch nur um 10 %. In einem tasmanischen Gebiet mit hoher Siedlungsdichte fanden sich entlang eines Baches Nester im Abstand von zwei Kilometern. Ort, Größe und Form der Brutterritorien werden in erster Linie vom Gelände und benachbarten Brutpaaren beeinflusst und erst im Laufe der Brutzeit endgültig bestimmt.[32]
In Wintergebieten in Tasmanien wurden Jagdgebiete von 2,9–3,9 km² Größe beobachtet, im Mittel 3,6 km². Dabei überlappten einzelne Jagdgebiete im Extremfall bis zu sechs anderen, was sich jedoch durch die Größe der Reviere über die Zeit relativierte; nur selten jagten zwei Vögel in weniger als 500 m Entfernung voneinander. In der Mehrheit der Fälle blieben die Weihen ihren Revieren auch in den Folgejahren treu, nur vereinzelt verließen Vögel ihre Territorien, etwa um sich Nistverbänden anzuschließen.[33] Außerhalb der Brutzeit wurde in Neuseeland ein Vogel pro 0,8 km² gezählt; einige Gebieten sollen sogar eine Siedlungsdichte von einem Vogel pro 0,5 km² erreichen.[7]
Balz und Paarung
Sumpfweihen bilden lediglich während der Fortpflanzungsperiode Paare, außerhalb der Brutsaison leben die Vögel als Einzelgänger.[2] Die Balz wird vom Männchen eingeleitet, indem es in große Höhe steigt und dort zu kreisen beginnt. Anschließend folgen wellenförmige Flugbewegungen mit übertriebenen Flügelschlägen, wobei sich das Männchen zuerst fallen lässt, um dann wieder steil nach oben zu schießen. Auf den Höhepunkten dieser Bewegung das Männchen vollführt das Männchen eine halbe oder ganze Rolle und stößt kii-a-Rufe aus, worauf das Weibchen mit kii-o antwortet. Zwischendurch lässt sich das Männchen immer wieder in Spiralen herabfallen. Stößt das Weibchen hinzu, stürzt sich das Männchen auf dieses, woraufhin das Weibchen eine Rolle macht und ihm die Krallen zeigt. Diese Art von Verfolgungsflug dauert in der Regel 30 Sekunden, anschließend landet das Paar am Boden.[7][34]
Das Männchen baut anschließend einen schlichten Nistplatz, an dem es dem umworbenen Weibchen Beute darbringt, indem es mit erhobenen Flügeln und einem tschuk-tschuk-tschuk-Ruf auf sich aufmerksam macht. Das Weibchen fliegt anschließend von einer nahen Sitzwarte herbei und frisst die vom Männchen erjagte Nahrung. Dieses partnerschaftliche Füttern dauert bis zur Eiablage Ende Oktober.[35]
Die Begattung wird vom Weibchen eingeleitet, indem es nahe dem Männchen landet und es mit einem siiiuh-Ruf zur Paarung einlädt. Das Männchen besteigt daraufhin das Weibchen, wobei es die Klauen schließt und mit den Flügeln versucht, die Balance zu halten. Die Kopulation dauert wenige Sekunden, anschließend trennen sich die Partner wieder, und das Männchen setzt sein übliches Paarungsverhalten fort.[35]
Die Sumpfweihe gehört zu den Angehörigen der Gattung Circus, bei denen Polygynie beobachtet wurde (etwa 11 % der Fälle). Dabei buhlt das Männchen um verfügbare Weibchen, auch wenn es bereits über einen Brutpartner verfügt. Anschließend besetzt jedes Weibchen Reviere und wird vom Männchen versorgt, wobei die Weibchen in Reihenfolge ihrer Paarung bevorzugt werden. Der Bruterfolg der bevorzugten Weibchen ist dadurch signifikant höher als der der nachrangigen. Diese Polyginie steht allerdings in keinem Zusammenhang zum Zahlenverhältnis der Geschlechter in einer Population, sondern scheint eher mit einem hohen Nahrungsangebot zu korrelieren.[36][37]
Brut und Aufzucht der Nestlinge
Die Brutsaison liegt zwischen September und Februar und damit etwas später als bei den meisten anderen Greifvögeln der Region, die Hauptbrutzeit liegt zwischen Oktober und Dezember. In nördlichen Gebieten oder bei Trockenheit beginnt die Sumpfweihe meist früher mit dem Nestbau als anderswo. Das Nest besteht aus Gras, Schilf und unter Umständen auch kleinen Stöcken, die vom Weibchen über zwei bis sechs Wochen auf dem Boden oder in seichtem Wasser zu einem losen, dichten Gebilde zusammengefügt werden. Es ist von ovaler Form, misst rund 50 × 80 cm und liegt 40 cm über dem Boden. Meist befindet sich das Nest in der Nähe von Bächen und anderen Gewässern oder in Getreidefeldern, wo die Vegetation vor Nesträubern und dem Wetter schützt; nur sehr selten brüten Sumpfweihen auch in Bäumen.[38][7][39][40]
Während der Inkubation und der vollständigen Abhängigkeit der Nestlinge übernimmt allein das Männchen die Nahrungsbeschaffung, während das Weibchen das Nest bewacht. Die Beute wird in der Luft übergeben, wobei das Weibchen vom Nest auffliegt, sobald das Männchen zurückkehrt. Es setzt sich im Flug etwa 1–2 m hinter das Männchen, woraufhin das Männchen abrupt nach oben zieht und gleichzeitig die Beute fallen lässt. Die so durch die Trägkeit kurz schwebende Beute wird vom Weibchen aus der Luft gegriffen, indem es sich auf den Rücken legt und mit den Klauen nach oben stößt. Anschließend fließt das Weibchen mit der Beute zum Nest. Die Ursache für diese Transfermethode liegt höchstwahrscheinlich daran, dass die Sumpfweihe Bodenbrüter ist und der Geruch am Boden übergebener Tiere Nesträuber anlocken könnte.[41]
Die Küken schlüpfen nach 31–34 Tagen und brauchen danach etwa 43–46 Tage, um flügge zu werden. Während dieser Zeit verstärkt das Männchen seine Nahrungslieferungen. Vier bis sechs Wochen nach dem Schlüpfen der Jungen beginnt auch das Weibchen ebenfalls wieder mit der Jagd. Die Abhängigkeit von den Eltern nach dem flügge werden zieht sich zwischen vier und sechs Wochen hin, bevor die Jungvögel komplett selbstständig geworden sind.[7][42][43]
Systematik
Äußere Systematik und Entwicklungsgeschichte
Sumpfweihen zeigen im Verhalten, bei der Ernährung und in den Erbanlagen eine nahe Verwandtschaft zu einer Reihe weiterer Weihen, die vorzugsweise Feuchtgebiete bewohnen, und deshalb in eine gemeinsame Gruppe, den sogenannten „Sumpfweihen“, gestellt werden.[44] Dabei ist die Sumpfweihe am nächsten mit der Rohrweihe (C. aeruginosus), sowie der Madagaskar- (C. macrosceles) und Réunionweihe (C. maillardi) aus dem Indischen Ozean verwandt, zumindest was die heute lebenden Arten der Gattung Circus betrifft. Die im 13. Jahrhundert ausgestorbene Eyles-Weihe (C. eylesi) wird als eine nahe Verwandte der Sumpfweihe betrachtet, mit der sie neben dem Lebensraum Neuseeland auch diverse morphologische Eigenschaften gemein hat. Die Vermutung, dass diese beiden Weihenarten einen gemeinsamen Vorfahren hatten, liegt auch durch den Umstand nahe, dass die Sumpfweihe bisher als einzige Art abgelegene Inseln im Pazifik besiedeln konnte; im Gegensatz zur anderen australischen Weihe, der Fleckenweihe (C. assimilis), die in Neuseeland nicht existiert.[18][45]
Die Verwandtschaftsverhältnisse der Sumpfweihe stellen sich laut Robert Simmons und Michael Wink (2000) wie folgt dar:[45]
| Habichtartige (Accipitridae) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Innere Systematik
Für die Sumpfweihe werden derzeit zwei Unterarten unterschieden, wobei diese Unterteilung umstritten ist:
- C. a. approximans Peale, 1848: Die Nominatform ist auf den Loyalitätsinseln, Neukaledonien, den Wallis-Inseln, Fidschi, Vanuatu und den Chatham-Inseln heimisch.
- C. a. gouldi Bonaparte, 1850: Diese Unterart ähnelt im Aussehen stark der Nominatform, sie ist für gewöhnlich dunkler gefärbt und die Strichelung der Unterseite ist kräftiger. Ihr Verbreitungsgebiet umfasst Neuseeland, Tasmanien und das australische Festland.
Die äußerliche Ähnlichkeit zwischen Papuaweihe (C. spilothorax) und Mangroveweihe (C. spilonotus) führte dazu, dass erstere früher als zur Mangroveweihe gehörig betrachtet wurde, da die Männchen beider Arten eine ähnliche Farbgebung besitzen. Später sahen jedoch einige Ornithologen eine nähere Verwandtschaft zur Sumpfweihe. Da es auch bei Jungtieren und Weibchen von spilothorax große Ähnlichkeiten zur Sumpfweihe gibt, wurde die Papuaweihe derzeit von diversen Autoren als deren Unterart geführt.
Diese Zuordnung blieb jedoch umstritten: Zwar sprachen sich James Ferguson-Lees und David Christie 2001 für eine Zugehörigkeit der Papuaweihe zur Sumpfweihe aus, wollten die Möglichkeit aber nicht ausschließen, dass sie eine eigenständige Art sein könnte.[7] Robert Simmons hingegen behandelte die Papuaweihe 2000 weder als Unterart der Mangrove- noch der Sumpfweihe, sondern als eigene Spezies. Dem schlossen sich Ferguson-Lees und Christie 2009 an.[46] Die DNS der Papuaweihe wird derzeit analysiert, die Publikation der Ergebnisse ist in Vorbereitung.[47]
Im Bezug auf C. a. gouldi und C. a. approximans befand David Baker-Gabb bereits 1979, dass die geringen morphologischen Unterschiede keine Unterteilung in eine australisch-neuseeländische und eine ozeanische Unterart zuließen. Die Konsequenz sei demnach, beide als zur Nominatform gehörig zu betrachten.[48] Hingegen spricht die große räumliche Trennung und die geringe Durchmischung der jeweiligen Populationen für eine Unterteilung.[7]
Bestand
In Neuseeland gilt die Sumpfweihe als häufigster Greifvogel und auch auf den pazifischen Inseln ist die Sumpfweihe offenbar häufig. Für die jeweiligen Populationen der Sumpfweihe in Australien, Neuseeland, Ozeanien und insbesondere Neuguinea liegen jedoch nur wenige Daten vor. Insgesamt umfassen die Brutgebiete der Sumpfweihe etwa 1,6 Mio. km²; Ferguson-Lees und Christie schätzen den Gesamtbestand auf eine Größenordnung von mehreren zehntausend Vögeln.[7]
Mortalitätsursachen, Krankheiten und Gefährdung

Neben Verhungern und Alterstod stehen die Mortalitätsursachen der Sumpfweihen vornehmlich im Zusammenhang mit dem Menschen, da ausgewachsene Sumpfweihen innerhalb ihres Verbreitungsgebiets kaum Fressfeinde besitzen. Weil die Sumpfweihe nicht nur im Ruf stand, Lämmer zu schlagen, sondern auch Fasane, Wachteln und andere Vögel tötete, die zu Jagdzwecken in Neuseeland ausgesetzt wurden, fielen vor allem in der ersten Hälfte des 20. Jahrhunderts viele Vögel dem gezielten Abschuss und der Vergiftung zum Opfer. Einige der sogenannten Acclimatisation Societies, die sich zum Ziel gesetzt hatten, englische Arten in Neuseeland anzusiedeln, setzten Prämien auf geschossene Sumpfweihen aus. In den 1930ern und 1940ern zahlte allein die Otago Acclimatisation Society innerhalb von sieben Jahren Prämien für 26.184 getötete Weihen, die Auckland Acclimatisation Society vermerkte über 200.000 Abschüsse in 15 Jahren. Schafzüchter wiederum rieben tote Lämmer oder andere Köder mit Strychnin ein, wodurch die Weihen unmittelbar sterben. Walter Lawry Buller schätzte die Zahl der Weihen, die so zu Tode kamen Ende des 19. Jahrhundert auf mehrere tausend Tiere pro Jahr. Auch heute werden Sumpfweihen bisweilen noch abgeschossen, unter anderem in den Schutzgebieten des Schwarzen Stelzenläufers (Himantopus novaezelandiae). Auch die aktive Bejagung des Kaninchens ab den 1950er Jahren trug möglicherweise zu einem Rückgang der neuseeländischen Population der Sumpfweihe bei.[49] Bisweilen werden einzelne Sumpfweihen von Flötenvögeln (Gymnorhina tibicen) angegriffen, dabei sind auch tödliche Angriffe dokumentiert.[50][51]
Die von anderen Greifvögeln bekannte Laus Degeeriella fusca befällt auch die Sumpfweihe. Aus Neuseeland wurde von Fällen berichtet, in denen die betroffenen Vögel an einer Schwellung der Zunge litten. Diese wurden durch Sehnen- und Muskelgewebe hervorgerufen, die sich um die Zunge gewickelt hatten. Offenbar stammte dieses Gewebe von Aas, was angesichts der zunehmenden Abhängigkeit neuseeländischer Weihen von dieser Nahrungsquelle mittelfristig ein Problem darstellen könnte. Die Vorliebe der Sumpfweihe für Aas stellt auch in anderer Hinsicht ein Problem dar: Da sich neuseeländische Sumpfweihen bevorzugt von durch Wildunfälle getötete Tiere ernähren, geraten sie selbst in Gefahr, überfahren zu werden. So wurden an stark befahrenen Straßen mit einer Gesamtlänge 33 km zwischen Juni 1985 und Oktober 1986 46 überfahrene Weihen gezählt, davon wurde die Hälfte während Mai (überwiegend Jungvögel) und Juli (durchgehend geschlossene Schneedecke auf den Straßen) getötet. Auch wird das Gefieder vieler Weihen in Kaninchenfallen stark beschädigt. Dabei werden die Federn entweder gebrochen oder durch die Fallen ausgerissen, was im Gefieder von Greifvögeln zu nachhaltigen Schäden führt.[52][53]
Ein großer Teil des Bestandes in Neuseeland ist von Bleivergiftung betroffen. Untersuchungen zur Bleibelastung bei neuseeländischen Vögeln ergaben bei 60 % der untersuchten Sumpfweihen eine erhöhte Bleikonzentration im Blut. Dabei gilt neben Bleifarben und Industrieabfällen vor allem Bleimunition als Hauptquelle für in die Umwelt gelangendes Blei. Dabei wird Blei auch mit Krankheitsbildern in Verbindung gebracht, bei denen die Füße der Vögel verkrampfen und sie so entscheidend beeinträchtigen. Zwar scheint Blei nicht die Alleinursache dieser Symptome zu sein, jedoch weisen Weihen mit verkrampften Klauen allesamt erhöhte Bleibelastungen auf. Vor allem die Vorliebe der Sumpfweihe für Aas, das aus Jagdmaßnahmen stammt, gilt hierbei als verhängnisvoll.[54]
Gefährdet sind Sumpfweihen vor allem durch die Trockenlegung von Feuchtgebieten und Wildunfälle. Die IUCN führt die Sumpfweihe als nicht gefährdet.[55][7]
Die Sumpfweihe in der Mythologie
In den Erzählungen der Māori nimmt die Sumpfweihe unter dem Namen Kāhu die Rolle eines Botschafters der Götter ein und genoss daher in den vergangenen Jahrhunderten unter den Māori hohes Ansehen. Die Färbung des Gefieders führten die Māori auf den Diebstahl des Feuers von Mahuika durch Māui zurück: Dabei sei die Sumpfweihe versengt worden und ihre Federn hätten sich dunkel gefärbt.[2][42][56]
Auch in der Mythologie einiger Aborigine-Stämme wird die Sumpfweihe, Joongabilbil genannt, mit der Gabe des Feuers in Verbindung gebracht. In den Erzählungen ist sie von dem Wunsch beseelt, den Menschen das Feuer zu bringen, was ihr erst nach mehreren Versuchen gelingt, bis sie schließlich einen Baum nach dem anderen in Brand setzt. Anschließend bringt sie den Menschen bei, wie sie mit trockenem Holz selbst Feuer entfachen können.[57]
Verweise
Literatur
- David John Baker-Gabb: Aspects of the biology of the Australasian Harrier. (Circus aeruginosus approximans Peale 1848). A thesis presented for the degree of Master of Science by thesis only in Zoology at Massey University. Massey University, Palmerston North 1978.
- David Baker-Gabb: Remarks on the Taxonomy of the Australasian Harrier (Circus approximans). In: Notornis. 26, Nr. 4, 1979, S. 325–329.
- David Baker-Gabb: The Diet of the Australasian Harrier in Manawatu-Rangitikei Sand Country. In: Notornis. 28, Nr. 4, 1981, S. 241–254.
- David Baker-Gabb: Ecological Release and Behavioural and Ecological Flexibility in Marsh Harriers on Islands. In: Emu. 82, Nr. 2, 1986, ISSN 0158-4197, S. 71–81.
- David Baker-Gabb: Wing-tags, winter ranges and movements of Swamp Harriers Circus approximans in southeastern Australia. In: Penny Olsen (Hrsg.): Australian Raptor Studies. Australasian Raptor Association R.A.O.U., Melbourne 1993, ISBN 1-875122-05-2, S. 248–261.
- David Baker-Gabb: Auditory location of prey by three Australian raptors. In: Penny Olsen (Hrsg.): Australian Raptor Studies. Australasian Raptor Association R.A.O.U., Melbourne 1993. S. 295–298.
- Walter Lawry Buller: A History of the Birds of New Zealand. 2 Bände. Selbstverlag, London 1888, S. 204–212.
- Les Christidis, Walter E. Boles: Systematics and taxonomy of Australian birds. CSIRO Publishing, Collingwood 2008, ISBN 978-0-643-06511-6, S. 117–118.
- John F. M. Fennel: An Observation of Carrion Preferrence by the Australasian Harrier (Circus approximans gouldi). In: Notornis. 27, Nr. 4, 1980, S. 404–405.
- James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin Harcourt, Boston MA 2001, ISBN 0-618-12762-3, S. 144–145, S. 503–505.
- James Ferguson-Lees, David A. Christie: Greifvögel der Welt. Franckh-Kosmos Verlag, Stuttgart 2009, ISBN 978-3-440-11509-1, S. 150.
- Nick C. Fox: Some morphological data on the Australasian Harrier (Circus approximans gouldi) in New Zealand. In: Notornis. 24, Nr. 1, 1977, S. 9–19.
- L. A. Hedley: Some observations of a communal roost of the Australian Harrier. In: Notornis. 23, Nr. 2, 1976, S. 85–89.
- Penny Olsen, T. G. Marples: Geographic Variation in Egg Size, Clutch Size and Date of Laying of Australian Raptors (Falconiformes and Strigiformes). In: Emu. 93, Nr. 3, 1993. S. 167–179.
- R. J. Pierce, R. F. Maloney: Responses of Harriers in the MacKenzie Basin to the abundance of rabbits. In: Notornis. 36, Nr. 1, 1989, S. 1–12.
- R. E. Redhead: Some aspects of the feeding of the harrier. In: Notornis. 16, Nr. 4, 1969. S. 262–284.
- Michael Sharland: The Swamp Harrier as a Migrant. In: Emu. 58, Nr. 2, 1958. S. 74–80.
- Robert E. Simmons: Harriers of the World: Their Behaviour and Ecology (= Oxford Ornithology Series 11). Oxford University Press, Oxford u. a. 2000, ISBN 0-19-854964-4.
- Robert E. Simmons, Leo A. T. Legra: Is the Papuan Harrier a globally threatened species? Ecology, climate change threats and first population estimates from Papua New Guinea. In: Bird Conservation International. 19, Nr. 1, 2009, ISSN 0959-2709, S. 1–13.
- Andrew M. Tollan: Maintenance Energy Requirements and Energy Assimilation Efficiency of the Australasian Harrier. In: Ardea. 76, Nr. 2, 1988, S. 181–186.
- Jennifer Marie Youl: Lead Exposure in Free-ranging Kea (Nestor notabilis), Tahake (Porphyrio hochstetteri) and Australasian Harriers (Circus approximans) in New Zealand. A thesis presented in partial fulfillment of the requirements for the degree of Masters of Veterinary Science in Wildlife Health at Massey University. Massey University, Palmerston North 2009, S. 1–31 u. 87–108.
Weblinks
- Neil Hetherington: Species Profile: Australasian Harrier www.canterburynature.org
- Narena Olliver: Kahu, the harrier hawk www.nzbirds.co.nz
- Literatur über die Sumpfweihe im Global Raptor Information Network
- Circus approximans in der Roten Liste gefährdeter Arten der IUCN. Eingestellt von: BirdLife International, 2008. Abgerufen am 26. November 2009.
- Videos, Fotos und Tonaufnahmen zu Circus approximans in der Internet Bird Collection
Einzelnachweise
- ↑ David Baker-Gabb: The Diet of the Australasian Harrier in Manawatu-Rangitikei Sand Country. In: Notornis. 28, Nr. 4, 1981, S. 241–254.
- ↑ 2,0 2,1 2,2 2,3 Neil Hetherington: Species Profile: Australasian Harrier www.canterburynature.org. September 2006. Abgerufen am 4. Januar 2010.
- ↑ Robert E. Simmons: Harriers of the World: Their Behaviour and Ecology. Oxford University Press, 2000, ISBN 0198549644, S. 35
- ↑ James Ferguson-Lees, David A. Christie: Raptors of the World. Houghton Mifflin Harcourt, 2001, ISBN 0618127623, S. 503–505.
- ↑ 5,0 5,1 Ferguson-Lees u. Christie 2001, S. 145, 504–505.
- ↑ Nick C. Fox: Some morphological data on the Australasian Harrier (Circus approximans gouldi) in New Zealand. In: Notornis. 24, Nr. 1, 1977. S. 10 (Online als PDF).
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 7,10 7,11 7,12 7,13 7,14 Ferguson-Lees und Christie 2001, S. 504–505.
- ↑ Walter Lawry Buller: A History of the Birds of New Zealand. 1888. S. 207. (Online als E-Book)
- ↑ 9,0 9,1 David Baker-Gabb: Aspects of the biology of the Australasian Harrier. (Circus aeruginosus approximans Peale 1848): a thesis presented for the degree of Master of Science by thesis only in Zoology at Massey University. Massey University, 1978. S. 21 & 26.
- ↑ 10,0 10,1 Fox 1977, S. 11.
- ↑ Simmons 2000, S. 97–124.
- ↑ 12,0 12,1 David Baker-Gabb: Ecological Release and Behavioural and Ecological Flexibility in Marsh Harriers on Islands. In: Emu 82, Nr.2 1986, S. 71–81.
- ↑ 13,0 13,1 13,2 Baker-Gabb 1978, S. 33.
- ↑ C. Blanvillain u.a.: Impact of introduced birds on the recovery of the Tahiti Flycatcher (Pomarea nigra), a critically endangered forest bird of Tahiti. In: Biological Conservation 109, Nr. 2, Februar 2003. S. 197-205.
- ↑ F. Harrison, M. Lewis: Swamp Harriers breeding in North Queensland. In: Australian Bird Watcher 17, 1997. S. 102–103.
- ↑ D. G. Gosper: Breeding of the Swamp Harrier on the NSW north coast. In: Australian Birds 27, 1994. S. 151.
- ↑ 17,0 17,1 Trevor H. Worthy and Richard N. Holdaway: Quaternary fossil faunas, overlapping taphonomies, and palaeofaunal reconstruction in North Canterbury, South Island, New Zealand. In: Journal of The Royal Society of New Zealand, Bd. 26, Nr. 3, 1996, S. 275–361 (Online als PDF).
- ↑ 18,0 18,1 Trevor H. Worthy & Richard N. Holdaway: The Lost World of the Moa. Prehistoric Life of New Zealand. Indiana University Press, Bloomington 2002, ISBN 0-253-34034-9, S. 355. Referenzfehler: Ungültiges
<ref>-Tag. Der Name „worthy355“ wurde mehrere Male mit einem unterschiedlichen Inhalt definiert. - ↑ 19,0 19,1 Michael Sharland: The Swamp Harrier as a Migrant. In: Emu 58, Nr. 2, 1958. S. 74–80.
- ↑ Nick Mooney: Status and Conservation of Raptors in Australia′s Tropics. In: Journal of Raptor Research. 32, Nr. 1, 1998, S. 67.
- ↑ Penny Olsen, T. G. Marples: Geographic Variation in Egg Size, Clutch Size and Date of Laying of Australian Raptors (Falconiformes and Strigiformes). In: Emu 93, Nr. 3, 1993, S. 168.
- ↑ R. E. Redhead: Some aspects of the feeding of the harrier. In: Notornis 16, Nr. 4, 1969. S. 278–280. (Online als PDF)
- ↑ Simmons 2000, S. 53.
- ↑ 24,0 24,1 Fergus Clunie: Harriers fishing. In: Notornis. 27, Nr. 2, 1980, S. 114 (Online als PDF).
- ↑ David Baker-Gabb: Auditory location of prey by three Australian raptors. In: Penny Olsen (Hrsg.): Australian Raptor Studies. Australasian Raptor Association, R.A.O.U. Melbourne 1993. S. 295–298.
- ↑ 26,0 26,1 Baker-Gabb 1979, S. 248–249.
- ↑ A. David, M. Latham: Australasian harrier (Circus approximans) observed feeding on crabs at Hooper's Inlet, Otago Peninsula. In: Notornis. 49, Nr. 1, 2002. S. 53–54 (Online als PDF).
- ↑ David J. Hawke, John M. Clark, Chris N. Challies: Verification of seabird contributions to Australasian harrier diet at Motunau Island, North Canterbury, using stable isotope analysis. In: Notornis. 52, Nr. 2, 2005 S. 158–162 (Online als PDF).
- ↑ John F. M. Fennel: An Observation of Carrion Preferrence by the Australasian Harrier (Circus approximans gouldi). In: Notornis. 27, Nr. 4, 1980, S. 404–405 (Online als PDF).
- ↑ Redhead 1969, S. 269.
- ↑ L. A. Hedley: Some observations of a communal roost of the Australian Harrier. In: Notornis. 23, Nr. 2, 1976, S. 85–89 (Online als PDF).
- ↑ 32,0 32,1 32,2 32,3 Baker-Gabb 1977, S. 27–30.
- ↑ David Baker-Gabb: Wing-tags, winter ranges and movements of Swamp Harriers Circus approximans in southeastern Australia. In: Penny Olsen (Hrsg.): Australian Raptor Studies. Australasian Raptor Association, R.A.O.U. Melbourne 1993. S. 248–261.
- ↑ Baker-Gabb 1978, S. 31–32.
- ↑ 35,0 35,1 Baker-Gabb 1978, S. 34–35.
- ↑ Simmons 2000, S. 34 u. 92.
- ↑ Baker-Gabb 1978, S. 36.
- ↑ Simmons 2000, S. 276–277.
- ↑ Redhead 1969, S. 281.
- ↑ Olsen 1993, S. 170.
- ↑ Baker-Gabb 1978, S. 39–40.
- ↑ 42,0 42,1 Narena Olliver: Kahu, the harrier hawk www.nzbirds.co.nz. 11. Juli 2005. Abgerufen am 4. Januar 2010.
- ↑ Simmons 2000, S. 43–49.
- ↑ Les Chrisitidis, Walter Boles: Systematics and taxonomy of Australian birds. CSIRO Publishing, 2008, ISBN 0643065113, S. 117–118.
- ↑ 45,0 45,1 Simmons 2000, S. 25.
- ↑ Simmons 2000, S. 22.
- ↑ Robert E. Simmons, Leo A. T. Legra: Is the Papuan Harrier a globally threatened species? Ecology, climate change threats and first population estimates from Papua New Guinea. In: Bird Conservation International. 19, Nr. 1, 2009, S. 1–13, doi:10.1017/S095927090900851X (Online als PDF).
- ↑ David Baker-Gabb: Remarks on the Taxonomy of the Australasian Harrier (Circus approximans). In: Notornis. 26, Nr. 4, 1979, S. 327–329 (Online als PDF).
- ↑ David John Baker-Gabb: The Diet of the Australasian Harrier in Manawatu-Rangitikei Sand Country. In: Notornis. 28, Nr. 4, 1981, S. 241–242 (Online als PDF).
- ↑ Dai Morgan, Joseph R. Waas, John Innes: Magpie interactions with other birds in New Zealand: results from a literature review and public survey. In: Notornis. 52, Nr. 2, 2005, S. 61–74 (Online als PDF).
- ↑ Buller 1888, S. 209.
- ↑ Fox 1977, S. 15–18.
- ↑ R. J. Pierce, R. F. Maloney: Responses of Harriers in the MacKenzie Basin to the abundance of rabbits. In: Notornis 36, Nr. 1, 1989, S. 9.
- ↑ Jennifer Marie Youl: Lead Exposure in Free-ranging Kea (Nestor notabilis), Tahake (Porphyrio hochstetteri) and Australasian Harriers (Circus approximans) in New Zealand. Massey University, Palmerston North 2009. S. 1–31 u. 87–108.
- ↑ Circus approximans in der Roten Liste gefährdeter Arten der IUCN. Eingestellt von: BirdLife International, 2008. Abgerufen am 26. November 2009.
- ↑ Narena Olliver: Maori Myths. www.nzbirds.com, 2005. Abgerufen am 4. Januar 2010.
- ↑ I. M. Odenberg: Aboriginal Tales Retold. www.theosophy-nw.org. Abgerufen am 12. Januar 2010.