Brustkrebs
- Seiten mit Skriptfehlern
- Wikipedia:Vorlagenfehler/Parameter:DOI
- Wikipedia:Exzellent
- Krebserkrankung
- Krankheitsbild in Gynäkologie und Geburtshilfe
- Weibliche Brust
| Klassifikation nach ICD-10 | |
|---|---|
| C50 | Mammakarzinom |
| C50.0 | Brustwarze und Warzenhof |
| C50.1 | Zentraler Drüsenkörper der Brustdrüse |
| C50.2 | Oberer innerer Quadrant der Brustdrüse |
| C50.3 | Unterer innerer Quadrant der Brustdrüse |
| C50.4 | Oberer äußerer Quadrant der Brustdrüse |
| C50.5 | Unterer äußerer Quadrant der Brustdrüse |
| C50.6 | Recessus axillaris der Brustdrüse |
| C50.8 | Brustdrüse, mehrere Teilbereiche überlappend |
| C50.9 | Brustdrüse, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Brustkrebs (medizinisch: Mammakarzinom) ist der häufigste bösartige Tumor der Brustdrüse des Menschen. Er kommt hauptsächlich bei Frauen vor; nur etwa jede hundertste dieser Krebserkrankungen tritt bei Männern auf.[1] In den westlichen Staaten ist Brustkrebs die häufigste Krebsart bei Frauen. Am Brustkrebs sterben mehr Frauen als an irgendeiner anderen Krebserkrankung. Die meisten Erkrankungen treten sporadisch (zufällig) auf, es gibt aber sowohl erbliche als auch erworbene Risikofaktoren. Neben der Heilung sind der Erhalt der betreffenden Brust und vor allem der Lebensqualität erklärtes Ziel der medizinischen Behandlung. Die Therapie besteht in der Regel in einer an das Erkrankungsstadium angepassten Kombination aus Operation sowie Zytostatika-, Hormon- und Strahlentherapie. Neue Ansätze aus dem Gebiet der Krebsimmuntherapie werden außerdem durch monoklonale Antikörper ermöglicht. Das medizinische Vorgehen basiert in hohem Maß auf Erfahrungen aus Studien und ist in weltweit akzeptierten Leitlinien standardisiert. Zahlreiche nationale und internationale Programme zur Früherkennung und zur strukturierten Behandlung sollen die Mortalität (Sterblichkeit) künftig senken.
Epidemiologie
In Deutschland ist das Mammakarzinom mit einem Anteil von 32 % aller Krebsneuerkrankungen die häufigste Krebserkrankung bei Frauen. Jede achte bis zehnte Frau erkrankt im Laufe ihres Lebens an Brustkrebs. Dies sind in Deutschland etwa 72.000 Neuerkrankungen pro Jahr oder 171 Fälle pro 100.000 Einwohner und Jahr. Bei internationalen Vergleichen muss die unterschiedliche Altersverteilung der nationalen Bevölkerungen berücksichtigt werden. Die nach dem sogenannten Europastandard (ESR) altersstandardisierte Inzidenz (Neuerkrankungsrate) liegt in Deutschland bei 123/100.000. Die brustkrebsbedingte Sterberate (Mortalität) beträgt 41/100.000 Frauen beziehungsweise altersstandardisiert 24,6/100.000 nach dem ESR.[2] Seit 1970 haben sich die Erkrankungszahlen verdoppelt, während die Mortalität eher rückläufig ist.[3]
In der westlichen Welt ist Brustkrebs die häufigste Todesursache bei Frauen zwischen dem 30. und 60. Lebensjahr. Weltweit gibt es nach Schätzungen der WHO (2003) zirka 1.050.000 neue Erkrankungsfälle pro Jahr, davon 580.000 in den Industriestaaten. Vergleichsweise seltener ist die Erkrankung in Afrika und Asien. Weltweit starben 1998 ca. 412.000 Frauen an Brustkrebs, das sind 1,6 % aller gestorbenen Frauen.[4] Brustkrebs ist weltweit der häufigste Krebs und die häufigste Todesursache bei Frauen. Während jedoch in den reichen Ländern die Sterberate sinkt, ist sie in den ärmeren Ländern hoch. Dies hängt zum einen mit der immer höheren Lebenserwartung zusammen, zum anderen mit den schlechteren diagnostischen und therapeutischen Möglichkeiten in den ärmeren Ländern. WHO-Angaben zufolge starben 2007 etwa 72 Prozent aller an Krebs erkrankten Menschen in Ländern mit mittlerem und niedrigem Einkommen.[5]
| Anzahl der in Deutschland am Mammakarzinom verstorbenen Frauen nach Altersgruppen [6] | ||||
| Alter | 2003 | 2004 | 2005 | 2006 |
|---|---|---|---|---|
| 0–30 | 1) 16 | 2) 20 | 16 | 13 |
| 30–40 | 348 | 318 | 294 | 294 |
| 40–50 | 1.271 | 1.296 | 1.283 | 1.176 |
| 50–60 | 2.493 | 2.404 | 2.419 | 2.489 |
| 60–70 | 4.158 | 4.441 | 4.252 | 4.035 |
| 70–80 | 4.140 | 4.354 | 4.273 | 4.283 |
| >80 | 4.747 | 4.759 | 4.918 | 4.996 |
| Gesamt | 17.173 | 17.592 | 17.455 | 17.286 |
| 1) ein Mädchen 5–10 Jahre 2) ein Mädchen 10–15 Jahre | ||||
| Anteil der Todesursache „Mammakarzinom“ in Prozent nach Altersgruppen (nur Frauen, Deutschland)[6] | ||||
| Alter | 2003 | 2004 | 2005 | 2006 |
|---|---|---|---|---|
| 0–30 | 0,4 | 0,5 | 0,5 | 0,4 |
| 30–40 | 10 | 11 | 10 | 11 |
| 40–50 | 13 | 14 | 14 | 13 |
| 50–60 | 14 | 14 | 13 | 14 |
| 60–70 | 9 | 10 | 10 | 10 |
| 70–80 | 4 | 5 | 4 | 5 |
| >80 | 2 | 2 | 2 | 2 |
Brustkrebs beim Mann
Männer erkranken seltener an Brustkrebs. Nach aktueller Statistik 2011 sind es in Deutschland jährlich etwa 500 Männer.[7] Das Verhältnis von Erkrankungen bei Männern zu Frauen liegt bei 1:100.[8] Die standardisierten globalen Inzidenzraten für Brustkrebs betrug bei Männern 0,40 pro 105 Personenjahre (66,7 pro 105 bei Frauen). Die Diagnosestellung erfolgt bei Männern in einem höheren medianen Alter (69,6 Jahre). Männliche Patienten weisen zwar eine schlechtere relative 5-Jahres-Überlebensrate auf als Frauen (0,72 [95 % KI: 0,70-0,75] bzw. 0,78 [95 % KI: 0,78-0,78]), was einem relativen erhöhten Mortalitätsrisiko von 1,27 (95 % KI: 1,13-1,42) entspricht, sie zeigen jedoch nach Anpassung um Alter und Jahr der Diagnosestellung, Stadium und Therapie ein signifikant besseres relatives Brustkrebs-assoziiertes Überleben als Patientinnen.[9] Die Mortalität bei Männern liegt bei rund 200 Todesfällen pro Jahr.
Den Aufbau und die Betreuung des 2010 in der Bundesrepublik gebildeten ersten „Selbsthilfe-Netzwerks für Männer mit Brustkrebs“ hat die bundesweite „Frauenselbsthilfe nach Krebs“ (FSH) in Bonn unter dem Patronat der Deutschen Krebshilfe übernommen.
„Grundsätzlich sind die Heilungschancen von Männern mit Brustkrebs nicht schlechter als die betroffener Frauen“, erklärte Gerd Nettekoven, Hauptgeschäftsführer der Deutschen Krebshilfe. Allerdings sei die Sterberate bei Männern in den vergangenen 25 Jahren im Gegensatz zu der bei Frauen nicht gesunken.[10] Die Ursachen seien vielfältig: Häufig würden Tumore der Brustdrüse bei Männern zu spät entdeckt. Aus Scham wollten Betroffene die Krankheitssymptome nicht wahrhaben und gingen zu spät zum Arzt.
Ursachen und Risikofaktoren
Genetische Risikofaktoren
Etwa 5 % der Brustkrebserkrankungen sind erblich bedingt.[11] Nur bei einer kleinen Gruppe von Frauen (etwa 1 pro 500) findet man definierte, krankheitsverursachende Mutationen. Wesentlich häufiger sind genetische Veränderungen, die die Suszeptibilität (Empfänglichkeit) für Brustkrebs auf äußere Faktoren erhöhen.
Die höchste Wahrscheinlichkeit, an der erblichen Form des Brustkrebs zu erkranken, besteht bei Frauen mit Mutation in den Breast-Cancer-Genen BRCA1 und BRCA2. Es kommt bereits bei einer Mutation in einem Allel dieser Gene zur Erkrankung (man spricht von sogenannten Proto-Onkogenen mit autosomal-dominantem Erbgang). Die Wahrscheinlichkeit, im Laufe des Lebens an Brustkrebs zu erkranken, wird für Trägerinnen des mutierten BRCA1 mit 65 %, für Trägerinnen des mutierten BRCA2 mit 45 % angegeben.[12]
Mutationen im p53-Gen, einem der Tumorsuppressorgene, werden autosomal-dominant vererbt (Li-Fraumeni-Syndrom). Weitere Genveränderungen, die das Risiko erhöhen, betreffen Mutationen von PTEN (Cowden-Syndrom), STK11 (Peutz-Jeghers-Syndrom) und CDH1 (E-Cadherin); deren Häufigkeit und Risikoerhöhung für die Brustkrebserkrankung ist jedoch nicht genau bekannt. Mäßig erhöht ist die Wahrscheinlichkeit bei Bestehen der seltenen genetischen Veränderungen mit mittlerer Penetranz, diese betreffen unter anderem die folgenden Gene: ATM (Ataxia teleangiectatica), CHK2 (checkpoint kinase 2) und BRIP-1.[13] Insgesamt lassen sich nicht mehr als fünf Prozent der Brustkrebserkrankungen auf diese Genveränderungen mit hohem oder mittlerem Risiko zurückführen.[14]
Die wesentlich häufigeren Allelveränderungen mit geringer Penetranz erhöhen das Brustkrebsrisiko höchstens auf das 1,25-fache bei heterozygoten Veränderungen und auf das 1,65-fache bei homozygoten Veränderungen. Dazu gehören insbesondere Veränderungen von FGFR2 (fibroblast growth factor receptor 2) und auf dem Chromosom 2q. Es wird geschätzt, dass solche Mutationen mit geringer Penetranz bei 58 % der Brustkrebserkrankungen eine Rolle spielen.[15]
Die Wahrscheinlichkeit, selbst zu erkranken, steigt statistisch nachweisbar ab zwei an Brustkrebs Erkrankten in der direkten Verwandtschaft an.[16] Familien, in denen mehrere Personen an Brust- oder Eierstockkrebs erkrankt sind, wird eine tumorgenetische Beratung in einem Beratungszentrum, beispielsweise aus dem Verbundprojekt familiärer Brustkrebs der Deutschen Krebshilfe empfohlen.[17]
Bei Frauen mit einer entsprechenden Prädisposition (hohe Wahrscheinlichkeit des Krankheitsauftretens) kann auf Wunsch eine beidseitige prophylaktische Mastektomie (Brustamputation) und / oder eine Eierstockentfernung vorgenommen werden: Einen gewissen Schutz vor einer Brustkrebserkrankung scheint die weitgehende Unterbindung der Östrogenproduktion durch die Entfernung beider Eierstöcke zu bieten. Verschiedene Autoren berichten von einer Verringerung des Erkrankungsrisikos von 50 bis 70 %, wenn in der Familie bereits Brustkrebs auftrat.[18]
Hormonelle Faktoren
Weibliche Körperzellen, auch Tumorzellen, tragen Rezeptoren für die Sexualhormone Estrogene und Gestagene. Viele Mammakarzinome werden in ihrem Wachstum durch diese Hormone beeinflusst. Östrogen- und progesteronhaltige Medikamente gegen Wechseljahresbeschwerden (Hormonersatztherapie) erhöhen das Erkrankungsrisiko um bis zu 45 %.[19] Auch Frauen mit früher Menarche (erstes Auftreten der Regelblutung in der Pubertät) und später Menopause (Ende der Menstruation, „Wechseljahre“) tragen ein etwas höheres Erkrankungsrisiko. Frauen, die früh Kinder bekommen und lange stillen, haben dagegen ein niedrigeres Risiko.[20]
Ob die Antibabypille das Risiko erhöht, ist substanz- und dosisabhängig und daher nicht vollständig geklärt. Die Nurses’ Health Study und weitere Studien haben eine Erhöhung des Risikos auf das 1,2- bis 1,4-fache nach einer Einnahme der „Pille“ über mehr als fünf Jahre gezeigt.
Schwangerschaftsabbrüche erhöhen das Brustkrebsrisiko einer Metaanalyse aus dem Jahr 2004 zufolge nicht.[21] Auch in anderen Studien mit hohen Fallzahlen konnte man einen solchen Zusammenhang nicht nachweisen.[22][23][24]
Phytoöstrogene sind Pflanzeninhaltsstoffe mit schwach östrogenartiger Wirkung. Ob Diäten, die reich an solchen Stoffen sind (etwa auf Sojabasis), das Erkrankungsrisiko erhöhen oder im Gegenteil durch Interaktion mit der körpereigenen Hormonproduktion senken, ist noch nicht bekannt, da die Ergebnisse der wissenschaftlichen Untersuchungen widersprüchlich sind.[25][26]
Linkshändigkeit
Im September 2005 sorgte eine Studie[27] für erhöhtes öffentliches Interesse[28][29], in der festgestellt wurde, dass Linkshänderinnen ein bis zu doppelt so hohes Risiko haben, vor der Menopause an Brustkrebs zu erkranken wie Rechtshänderinnen. Schon fünf Jahre zuvor war eine andere Studie zu einem ähnlichen Ergebnis gekommen (Risikozunahme +42 %).[30] Eine Studie aus dem Jahr 2007 kommt sogar auf eine um den Faktor 2,59 erhöhte Brustkrebswahrscheinlichkeit bei Linkshänderinnen.[31]
Die Mechanismen für das erhöhte Brustkrebsrisiko bei Linkshänderinnen sind noch weitgehend ungeklärt. Eine in Fachkreisen diskutierte Hypothese besagt, dass eine pränatale Einwirkung von erhöhten Dosen von Sexualhormonen auf den Embryo die Ursache ist. Die Sexualhormone bewirken dabei – so die Hypothese – zum einen, dass das Kind linkshändig wird und zum anderen, dass sich das Brustgewebe verändert und anfälliger für eine Krebserkrankung wird.[30] Die Linkshändigkeit ist dabei gewissermaßen ein Indikator für erhöhte Konzentrationen an Steroiden in der Gebärmutter. Die Hypothese, dass die Grundlage für die Entstehung von Brustkrebs durch die Einwirkung von Sexualhormonen im embryonalen Stadium gebildet werden kann, wird schon seit 1990 diskutiert[32] und basiert auf dem Geschwind-Behan-Gallura-Modell. Dass Sexualhormone – insbesondere Testosteron – in utero einen Einfluss auf die Ausbildung der Händigkeit haben können, wurde bereits 1985 gezeigt.[33][34]
Linke Brust häufiger als rechte Brust
Statistisch gesehen ist die linke Brust, sowohl bei Frauen als auch Männern, häufiger von Brustkrebs betroffen als die rechte.[35] Davon sind alle Populationen betroffen.[36] Mit zunehmendem Alter wird der Unterschied noch größer.[37] Diese für die linke Brust erhöhte Rate trifft offensichtlich nicht für Tumore zu, die ihren Entstehungsort im oberen äußeren Quadranten haben.[38] Die Wahrscheinlichkeit, dass die linke Brust an Krebs erkrankt, ist – je nach Studie – um fünf bis sieben Prozent höher als bei der rechten.[35] Bei Männern liegt dieser Wert sogar bei zehn Prozent.[39]
Die Ursachen für dieses Phänomen sind noch weitgehend unklar.[40] Diskutiert werden unter anderem Schlafgewohnheiten[41], Händigkeit[42][43], Unterschiede in der Brustgröße und der Gehirnstrukturen, sowie Präferenzen beim Stillen.[41] Eine andere Hypothese sieht in der embryonalen Entwicklung des auf der linken Körperseite befindlichen Herzens eine mögliche Ursache.[44]
Bei anderen Organen, wie beispielsweise der Lunge und den Hoden, ist eine ähnliche statistische Häufung zu beobachten. Bei diesen beiden Organen ist die Wahrscheinlichkeit, dass die rechte Hälfte des Organs betroffen ist, um 13 % höher. In diesen Fällen erklärt man sich diesen Unterschied durch das meist kleinere Gewebevolumen der linken Organhälfte.[35]
Weitere Faktoren
Die Exposition mit ionisierender Strahlung in jungen Jahren erhöht das spätere Brustkrebsrisiko.[45] Mammographie-Untersuchungen bei Frauen über 40 Jahren führen zu keiner bedeutsamen Risikosteigerung mehr.[46]
Auch die Lebensweise beeinflusst das Risiko. So erkranken deutlich übergewichtige Frauen 2,5 mal so häufig wie normalgewichtige.[47] Starkes und langdauerndes Zigarettenrauchen erhöht die Erkrankungswahrscheinlichkeit um 30 %.[48] Auch Frauen, die täglich mindestens 20 g Alkohol trinken, tragen ein um 30 % erhöhtes Risiko, an einem Mammakarzinom zu erkranken, möglicherweise wegen des höheren Sexualhormonspiegels.[47] Ein weiterer Risikofaktor könnte Sonnen- bzw. Vitamin-D-Mangel sein. Dieser Zusammenhang wird auch für Prostatakrebs, Dickdarmkrebs, Ovarialkrebs, Melanome und Blasenkrebs vermutet.[49] Wenn ältere, (postmenopausale) Frauen zur Vorbeugung gegen Knochenbrüche Calcium und Vitamin D einnehmen, scheint deren Erkrankungsrisiko stark zu sinken.[50] Frauen mit niedrigem Vitamin-D-Plasma-Spiegel haben bei Brustkrebs ein erhöhtes Risiko für Fernmetastasen. 512 Frauen mit einem Durchschnittsalter von 50 Jahren mit Brustkrebs im Frühstadium wurden in einer prospektiven Kohortenstudie untersucht. Dabei wurden die 25-Hydroxyvitamin-D-Spiegel bei der Erstdiagnose gemessen. Dabei wiesen 192 Frauen einen Vitamin-D-Mangel (unter 50 nmol/l) und 197 Frauen einen verringerten Vitamin-D-Spiegel (50 bis 72 nmol/l) auf. 123 Studienteilnehmerinnen hatten einen ausreichenden Vitamin-D-Spiegel (über 72 nmol/l). Patientinnen mit höhergradigen Brusttumoren (G3) hatten signifikant niedrigere Vitamin-D-Spiegel als Frauen mit Gl-Tumoren. 116 der 512 Frauen erlebten während der durchschnittlich 11,6-jährigen Beobachtungszeit eine Fernmetastasierung und 106 Patientinnen starben in diesem Zeitraum. Der Vitamin-D-Spiegel war sowohl für das fernmetastasierungsfreie Überleben als auch für das Gesamtüberleben der Frauen ein signifikanter Prognosefaktor. Patientinnen mit einem verminderten Vitamin-D-Spiegel hatten im Vergleich zu Frauen mit ausreichendem Vitamin-D-Spiegel ein nahezu doppelt so hohes Risiko für eine Fernmetastasierung. Die Sterberate war um den Faktor 1,73 erhöht. Die schlechte Prognose bei zu niedrigem Vitamin-D-Spiegel war unabhängig vom Alter, Body Mass Index (BMI) oder Tumorstadium.[51]
Brustkrebsauslösung durch eine Infektion („Brustkrebsvirus“) wurde bisher nicht nachgewiesen. Brustimplantate verursachen keinen Brustkrebs[52], ebenso wenig wie das Tragen von Büstenhaltern.[52]
Seit einigen Jahren wird außerdem eine aktive Rolle von Endothelin und Endothelin-konvertierendem Enzym (ECE) im Rahmen der Brustkrebsentstehung und insbesondere der Metastasierung von Brustkrebszellen diskutiert.[53]
Früherkennung und Screening
Etwa 80 bis 90 % aller Geschwulste in der weiblichen Brust wurden bisher von den Frauen selbst zufällig entdeckt. Diese tast- und sichtbaren Tumoren sind bei ihrer Entdeckung oft schon relativ groß und sind deshalb meist mit einer schlechten Prognose verbunden. Durch konsequente Früherkennung kleinerer, nicht tastbarer Tumoren könnte die Sterblichkeit großen Studien zufolge um 25 % gesenkt werden. Zur Früherkennung dienen Programme zur systematischen Selbstuntersuchung sowie die Screening-Mammographie.
Selbstuntersuchung
Systematische Schulungen der Frauen zur Brust-Selbstuntersuchung sind in ihrem Nutzen umstritten. Nicht jede Brustkrebserkrankung führt zu einer tastbaren Geschwulst. Umgekehrt ist nur etwa jede zwölfte selbst ertastete Veränderung bösartig.[54] Studien zufolge senkt die systematische Selbstuntersuchung der Brust die Sterblichkeit nicht.[55][56] Die US-amerikanische Preventive Services Task Force (USPSTF) gibt wegen der unzureichenden Datenlage keine Empfehlung für oder gegen die Brustselbstuntersuchung.[57] Die kanadische Task Force on Preventive Health Services gab 2001 eine Empfehlung gegen die Selbstuntersuchung ab[58], weil die Entdeckungsrate schlecht und falsch positive Befunde häufig seien.
Zum Erlernen der Selbstuntersuchung gibt es Brustmodelle aus Silikon, die verschiedene Knotentypen enthalten; beigefügt sind Begleitvideo und Anleitung. Die Kosten hierfür werden jedoch in Deutschland nicht von der Krankenkasse bzw. Pflegeversicherung übernommen.[59]
In Deutschland wird die Selbstuntersuchung von den medizinischen Fachgesellschaften empfohlen[60], weil sie zur Bewusstseinsbildung der Frauen beitrage und so die eigentliche Früherkennung durch apparative Verfahren begünstige. Die Selbstuntersuchung, die monatlich zirka fünf bis sieben Tage nach Einsetzen oder kurz nach dem Ende der Regelblutung durchgeführt werden soll, erfolgt nach einem bestimmten, sich immer wiederholenden Muster. Bei ertasteten Auffälligkeiten sollen Frauen einen Facharzt aufsuchen.
Ärztliche Krebsfrüherkennung
Die klinische Untersuchung der Brust durch einen Arzt ist Bestandteil des gesetzlichen Krebs-Früherkennungsprogramms ab dem 30. Lebensjahr. Für die Aussagefähigkeit der ärztlichen Tastuntersuchung gilt im Prinzip dieselbe Einschränkung wie für die Selbstuntersuchung.
Brustkrebsfrüherkennung durch Blinde
Blinde Menschen verfügen in der Regel über einen überdurchschnittlich trainierten Tastsinn. Diese besondere Fähigkeit wird für die Früherkennung von Brustkrebs genutzt. Im Rahmen des in Nordrhein-Westfalen angesiedelten Modellprojektes „Discovering hands“ (Entdeckende Hände) wurde der Ausbildungskurs der Medizinischen Tastuntersucherin geschaffen.
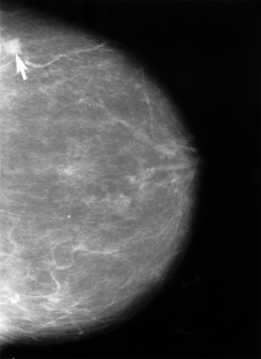
Bildgebende Verfahren
Die Röntgen-Mammographie ist einer S3-Leitlinie (Medizinische Leitlinie der höchsten Qualitätsstufe) zufolge bis jetzt das einzige Verfahren, dessen Eignung zur Erkennung früher Karzinome und Karzinomvorstufen allgemein anerkannt ist.[60] Die Mamma-Kernspintomographie ist möglicherweise überlegen, jedoch für ein Massenscreening zu teuer.[61] In Deutschland wurde deshalb ein qualitätsgesichertes Mammographie-Screening-Programm auf der Grundlage der „Europäischen Leitlinien für die Qualitätssicherung des Mammographie-Screenings“ für Frauen von 50 bis 69 Jahren aufgebaut. Dazu wurde Deutschland in 94 Regionen aufgeteilt, für die jeweils eine Screening-Einheit verantwortlich ist.[62] In den USA gibt es die Empfehlung, das Mammographiescreening bereits mit 40 Jahren zu beginnen.[57]
Durch Dreifachbefundung und weitere Diagnostik soll erreicht werden, dass möglichst wenige gutartige Mammatumoren biopsiert oder gar entfernt werden. Die EUREF-Richtlinie verlangt, dass in mindestens 50 % der genommenen Gewebeproben bösartige Tumoren nachgewiesen werden können;[63] in manchen Untersuchungsprogrammen werden bis zu 80 % erreicht.[64]
CAD-Systeme (Computer-assisted Detection) können den Radiologen bei der Auswertung der Mammographien unterstützen. Solche Untersuchungen können in den USA und den Niederlanden von den Krankenkassen bezahlt werden. Nach bisher veröffentlichten Studien verbessern die bislang verfügbaren Geräte die Erkennungsrate jedoch nicht.[65] In den europäischen Screeningprogrammen wird daher die Doppelbefundung durch zwei Ärzte (und durch einen dritten bei Auffälligkeiten) bevorzugt.
Die Mammographie ist bei Frauen mit dichtem Drüsengewebe in ihrer Aussagekraft begrenzt. Bei extrem dichtem Gewebe werden etwa 50 % der Brusttumoren mit der Mammographie nicht entdeckt. Dies betrifft in erster Linie jüngere Frauen. Frauen mit dichtem Gewebe im Mammogramm wird daher der Einsatz eines zweiten Untersuchungsverfahrens (in der Regel Sonographie, im Einzelfall auch Kernspin-Mammographie) empfohlen.
Diagnose
Klinische Untersuchung
Bei der Selbstuntersuchung oder bei der ärztlichen, klinischen Untersuchung kann ein neuer, unscharf begrenzter Tumor auffallen. Weitere Anzeichen sind Verhärtungen, Größen- und Umrissveränderungen der Brust im Seitenvergleich, verminderte Bewegung der Brust beim Heben der Arme, bleibende Hautrötung, Hauteinziehung oder Apfelsinenhaut (verdickte Haut mit eingezogenen Stellen), Einziehung oder Entzündung der Brustwarze, Absonderungen aus der Brustwarze. Knoten in der Achselhöhle können Lymphknoten-Metastasen entsprechen. Allgemeinsymptome bei weit fortgeschrittenen Erkrankungen sind u. a. Leistungsknick, ungewollter Gewichtsverlust oder Knochenschmerzen.
Ein lange Zeit unbehandeltes Mammakarzinom oder ein nicht kontrollierbares lokales Tumorrezidiv kann sich lymphangitisch oder subkutan infiltrierend soweit ausdehnen, dass die gesamte Brustwand panzerförmig ummauert erscheint; dieser Zustand wird als Cancer en cuirasse (Panzerkrebs) bezeichnet.[66]
Bildgebende Diagnostik
Werden bei der Tast- oder Ultraschalluntersuchung Auffälligkeiten gefunden, folgt als nächste Untersuchung üblicherweise die Mammographie: Die Röntgenaufnahmen werden aus zwei Blickrichtungen (von der Seite und von oben) gemacht, bestimmte Veränderungen erfordern manchmal zusätzliche Aufnahmen. Die Galaktographie wird nur durchgeführt, wenn die Brustwarzen Sekret absondern. Als Ergänzung steht bei einer solchen Sekretion an einigen Zentren die Duktoskopie, eine Spiegelung der Milchgänge, zur Verfügung.
Umgekehrt werden mit der Mammographie entdeckte Veränderungen immer sonographisch nachuntersucht. Dabei werden gutartige Zysten erkannt. Die Leitlinie der Kassenärztlichen Bundesvereinigung schreibt hierfür Schallköpfe mit mindestens 5 MHz Frequenz vor.[67]
Die Kernspintomographie der Brust (MR-Mammographie, MRT) wird zurzeit nur empfohlen für das invasive lobuläre Mammakarzinom zur Bestimmung der Resektions-Grenzen und allgemein bei Verdacht auf das Vorliegen mehrerer Tumorherde[68], gegebenenfalls ist auch eine MRT-gesteuerte Biopsie möglich. Nach brusterhaltender Therapie kann die MRT eingesetzt werden, um zwischen narbigen Verdichtungen in der operierten Brust und neuem Tumorwachstum zu unterscheiden. Außerhalb der ambulanten Versorgung der gesetzlich krankenversicherten Patientinnen gibt es weitere Indikationen.
Die Positronen-Emissions-Tomographie ist derzeit keine Routinemethode, kann jedoch eingesetzt werden, um nach dem Primärtumor bzw. dessen Metastasen zu suchen, wenn dieser mit anderen Methoden nicht gefunden werden kann.
Knochenszintigramme, Computertomographien, Röntgenaufnahmen der Lunge, Sonographien der Leber und ggf. Kernspintomographien dienen dazu, nach Metastasen zu suchen, also die Ausbreitung der Erkrankung zu erkennen.
Gewebeentnahmen
Wurde mit dem Ultraschall und der Mammographie ein Tumor diagnostiziert, wird dieser auf seine Gut- oder Bösartigkeit untersucht. Dazu werden jedem Tumor mittels Stanzbiopsie, in seltenen Fällen mittels Vakuumbiopsie, mehrere Gewebeproben entnommen und unter dem Mikroskop auf Krebszellen untersucht. Methode der Wahl für die Probenentnahme tastbarer und sonografisch sichtbarer Befunde ist die Stanzbiopsie, für im Kernspintomogramm sichtbare Befunde und Mikrokalzifikationen die stereotaktisch gestützte Vakuumbiopsie. Wurde der Tumor als bösartig erkannt, wird das Karzinom durch weitere Untersuchungen des entnommenen Gewebes näher bestimmt. Hierzu gehören der Status der Hormon- und HER2/neu-Rezeptoren sowie der Entartungsgrad.
Nach der Operation wird das aus der Brustdrüse entfernte Operationspräparat in der histologischen Untersuchung auf seine exakte Größe gemessen und das Gewebe auf weiteren Befall untersucht. Die entfernten Lymphknoten werden auf Metastasen geprüft. Die Größe des Karzinoms und die Anzahl der befallenen Lymphknoten sind für die TNM-Klassifikation, Prognose und weitere Behandlung von Bedeutung. Das Operationspräparat wird auch daraufhin vermessen, ob der Abstand zwischen dem Karzinom und dem verbliebenen, gesunden Gewebe ausreichend groß ist. Sollte dies nicht der Fall sein, kann eine Nachoperation nötig werden, damit ein angemessener Sicherheitsabstand zwischen gesundem und erkranktem Gewebe erreicht wird.
Gentest
Oncotype DX ist ein diagnostischer Gentest für Patientinnen, die an frühem und hormonrezeptorpositivem Brustkrebs erkrankt sind. Er untersucht die Eigenschaft und Aktivität von insgesamt 21 Genen in Gewebeproben eines Brustkrebstumors und hilft damit, diejenigen Patientinnen, die von einer adjuvanten Chemotherapie profitieren können und diejenigen Patientinnen, denen diese nebenwirkungsreiche Therapie erspart werden kann, voneinander zu unterscheiden.
Klassifikation
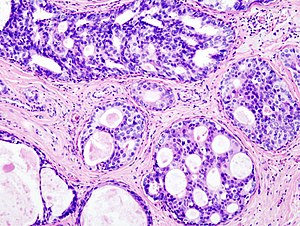
Die Klassifikation eines Tumors ist dessen exakte Beschreibung auf der Grundlage der pathologischen Untersuchung einer Gewebeprobe oder des OP-Präparats und der entnommenen Lymphknoten.
Histologische Klassifikation
Quelle:[69]
Der häufigste Tumortyp des Mammakarzinoms ist mit etwa 70–80 % ein Adenokarzinom ohne besondere Merkmale; dieser Tumortyp wird als invasives duktales Karzinom (IDC) bezeichnet. Seltener (in etwa 10–15 %) sind das invasive lobuläre Karzinom (ILC), das invasive tubuläre, muzinöse, medulläre, papilläre Karzinom (je etwa 2 %), gemischte und andere Tumortypen. Diese Tumortypen unterscheiden sich in ihrer klinischen Präsentation, den Befunden bei bildgebenden Untersuchungen, dem histologischen Ausbreitungsmuster und in der Prognose. Bei fast allen Tumortypen liegt auch eine nicht invasive (duktale oder lobuläre) Tumorkomponente vor, aus der sie hervorgegangen sind und die für die Größe der Operation mitentscheidend ist. Seltener geht das Mammakarzinom direkt aus gutartigen Erkrankungen hervor (von denen einige bei Mammatumor genannt sind, es handelt sich hier aber nicht um bösartige Tumorerkrankungen).
Als inflammatorisches Mammakarzinom bezeichnet man keinen histologischen Tumortyp, sondern eine sicht- und tastbare Veränderung, nämlich eine Rötung von mindestens einem Drittel der Brusthaut und Schwellung der Brust durch Infiltration der Lymphbahnen. Meist liegt ein lokal fortgeschrittener Befall der Brust und des umgebenden Lymphsystems vor.
Die nicht-invasiven Karzinome sind definiert als Karzinome innerhalb der Brustdrüsengänge (duktales Carcinoma in situ, DCIS) oder -läppchen (lobuläres Carcinoma in situ, LCIS bzw. Lobuläre Neoplasie, LN) ohne Stromainvasion. Eine Sonderstellung nimmt der Morbus Paget der Brustwarze (Mamille) ein, der auf einer nicht-invasiven Tumorausbreitung in die Mamillenhaut beruht und in der Regel mit einem intraduktalen Mammakarzinom, seltener auch mit einem invasiven Mammakarzinom assoziiert ist. Dieses Paget-Karzinom der Brustwarze kann klinisch mit einem Ekzem oder gutartigen Geschwür verwechselt werden.
Differenzierungsgrad
Die histologischen Tumortypen werden anhand struktureller und zellulärer Eigenschaften sowie ihrer Kernteilungsrate unterteilt in drei Differenzierungsgrade (synonym Malignitätsgrad, englisch auch Grading). Die Einstufung des invasiven Karzinoms beruht auf den drei Kriterien Tubulusbildung (Ausbildung röhrenartiger Tumordrüsen), Kernpolymorphie (Vielgestaltigkeit der Zellkerne) und Mitoserate (Teilungsrate der Zellen) nach Elston und Ellis.[70] Je höher das Grading, desto ungünstiger ist das Verhalten der Tumorzellen. Man unterscheidet Tumoren mit Differenzierungsgrad 1, 2 oder 3 (G1 = gut differenziert, G2 = mäßig differenziert, G3 = gering differenziert).
TNM-Klassifikation
Die TNM-Klassifikation beschreibt die Größe des Tumors (T), die Anzahl der befallenen Lymphknoten (N) und eine eventuelle Fernmetastasierung (M). Die tabellierte Kurzfassung der TNM-Klassifikation für Brustkrebs:
| T Tumorgröße | |
|---|---|
| T0 | kein Tumor nachweisbar |
| Tis | Carcinoma in situ, nicht invasiv |
| T1mic | Mikroinvasion bis 0,1 cm |
| T1 | bis 2 cm |
| T1a | < 0,5 cm |
| T1b | > 0,5 cm bis 1 cm |
| T1c | > 1 cm bis 2 cm |
| T2 | > 2 cm bis 5 cm |
| T3 | > als 5 cm |
| T4 | jede Größe mit Ausdehnung auf die Brustwand oder Haut |
| N Befallene Lymphknoten | |
|---|---|
| N0 | keine |
| N1 | 1–3 in der Achsel |
| N2 | 4–9 in der Achsel |
| N3 | 10 oder mehr in der Achsel oder unter/über dem Schlüsselbein |
| M (Fern-) Metastasen | |
|---|---|
| M0 | keine nachweisbar |
| M1 | nachweisbar (meist Lunge, Leber, Knochen) |
Stadieneinteilung
Aus der TNM-Klassifikation (bzw. pTNM-Klassifikation, das 'p' steht für histologisch gesicherte Daten) des Mammakarzinoms ergibt sich die Stadiengruppierung nach UICC bzw. AJCC (TNM 6. Aufl., 2003) wie folgt:
| Stadium 0 | Tis | N0 | M0 |
| Stadium I | T1 | N0 | M0 |
| Stadium IIA | T0,T1 | N1 | M0 |
| T2 | N0 | M0 | |
| Stadium IIB | T2 | N1 | M0 |
| T3 | N0 | M0 | |
| Stadium IIIA | T0,T1,T2 | N2 | M0 |
| T3 | N1,N2 | M0 | |
| Stadium IIIB | T4 | N0,N1,N2 | M0 |
| Stadium IIIC | Jedes T | N3 | M0 |
| Stadium IV | Jedes T | Jedes N | M1 |
Hormonrezeptor- und HER2-Status
Der Östrogenrezeptor- und Progesteronrezeptorstatus (ER- und PgR-Expression) wird ebenfalls histologisch, genauer immunhistologisch untersucht. Man bestimmt den Prozentsatz derjenigen Tumorzellen, an denen sich die Rezeptoren nachweisen lassen und errechnet aus Prozentsatz und der Färbeintensität einen 12-stufigen Immunreaktiven Score (IRS), oder den international gebräuchlicheren 8-stufigen Allred-Score.
| Färbeintensität (IS) | Positive Zellen (PP) | ||
|---|---|---|---|
| 0 | keine Reaktion | 0 | keine |
| 1 | schwache Reaktion | 1 | weniger als 10 % |
| 2 | mäßige Reaktion | 2 | zwischen 10 und 50 % |
| 3 | starke Reaktion | 3 | zwischen 51 und 80 % |
| 4 | mehr als 80 % | ||
| IRS | |
|---|---|
| 0–2 | negativ |
| 3–4 | schwach positiv |
| 6–8 | mäßig positiv |
| 9–12 | stark positiv |
Beim HER2-Rezeptor, der für die Entscheidung, ob eine Nachbehandlung mit Trastuzumab sinnvoll ist, wird ein 4-stufiger Score angewandt, der sich nach der immunhistochemischen Färbeintensität richtet (ASCO-Empfehlung 2007[71]). Lassen sich keine Zellen anfärben, ist das Ergebnis negativ: Score 0. Auch der Score 1+ ist negativ, d. h. eine Behandlung mit Trastuzumab wäre ohne Effekt auf den Tumor. Bei einer mittleren Färbeintensität (Score 2) wird der Tumor mit dem FisH-Test nachuntersucht und anhand Vermehrung (Amplifikation) des HER2-Gens entschieden, ob es sich um einen HER2-positiven Tumor handelt.
| Positive Zellen | Membranfärbung | Färbeintensität | Score |
|---|---|---|---|
| keine | keine | keine | 0 |
| 1 % oder mehr | nicht komplett | schwach | 1+ |
| weniger als 10 % | vollständig | schwach bis mäßig | 1+ |
| 10 % oder mehr | vollständig | schwach bis mäßig | 2+ |
| 30 % oder weniger | vollständig | stark | 2+ |
| mehr als 30 % | vollständig | stark | 3+ |
Risikogruppen, Einteilung nach Ergebnissen der Konsensuskonferenzen in St. Gallen
Die alle zwei Jahre in St. Gallen abgehaltene Konsensuskonferenz beschäftigt sich vor allem mit der adjuvanten Therapie. Um die Chemo- und Hormontherapie möglichst zielgerecht einsetzen zu können, werden der Empfehlung von 2007 folgend die operierten Patientinnen in drei Risiko-, besser Behandlungsgruppen eingeteilt[72]:
| Niedriges Risiko | Mittleres Risiko | Hohes Risiko | |
|---|---|---|---|
| Anzahl der befallenen Lymphknoten: |
keiner und alle folgenden Kriterien: | 1 bis 3 oder keiner, aber mindestens ein weiteres Kriterium: |
mehr als 4 oder 1 bis 3 und |
| Tumorgröße: | T1 (max. 2 cm) | T2 bis T4 (größer als 2 cm) | |
| Differenzierung: | G1 | G2 und G3 | |
| Tumoreinbruch: | Invasion in Gefäße | ||
| Hormonstatus: | ER/PR-positiv (Östrogen-/Progesteron-positiv) | ||
| HER2/neu-Status: | HER2/neu-negativ | HER2/neu-positiv | HER2/neu-positiv |
| Alter: | 35 Jahre und älter | oder jünger als 35 Jahre |
Molekulare Tumorklassifikation
Anhand des Genexpressionsprofils, welches mit DNA-Microarrays aus dem Tumorgewebe gewonnen werden kann, kann man fünf verschiedene Hauptgruppen des Mammakarzinoms unterscheiden: Hormonrezeptorpositive Tumoren mit geringer bzw. höherer Aggressivität (genannt Luminal-A und Luminal-B), HER2-positive Tumoren (erbB2-Phänotyp) und Hormonrezeptor- und HER2-negative Karzinome mit oder ohne Basalzell-Eigenschaften (basal-like und normal-like Phänotypen). Die zurzeit noch experimentelle molekulare Tumorklassifikation könnte in Zukunft eine bessere Abschätzung der Prognose und der voraussichtlichen Wirkung der adjuvanten Hormon- und Chemotherapie ermöglichen.[73]
Therapie
Zur Vereinheitlichung und Verbesserung der Krankenversorgung gibt es in Deutschland seit 2003 im Auftrag der Deutschen Krebsgesellschaft und der Deutschen Gesellschaft für Senologie von OnkoZert zertifizierte Brustzentren an Krankenhäusern[74] und seit 2004 ein Disease-Management-Programm für Brustkrebs, an dem sich auch niedergelassene Ärzte beteiligen können. Die gemeinsame Leitlinie der Stufe S3 der Deutschen Krebsgesellschaft und der medizinischen Fachgesellschaften ist für diese Programme die Orientierung zur Behandlung von Brustkrebs. Diese Leitlinie wird regelmäßig aktualisiert, zuletzt im Juli 2012.[68]
Die Strategie zur Brustkrebsbehandlung wird meist im Rahmen einer Tumorkonferenz geplant, an der sich Gynäkologen, internistische Onkologen, Radiologen, Strahlentherapeuten und Pathologen beteiligen. Die Einbindung der Patientin in die Entscheidungsfindung ist wie bei jeder eingreifenden medizinischen Maßnahme von großer Bedeutung (siehe informierte Einwilligung). Auch der deutsche Gesetzgeber spricht in der DMP-Richtlinie deutlich vom Status der aufgeklärten Patientin.[75]
Die Therapie der Brustkrebserkrankung soll im Frühstadium eine Heilung, beim metastasierten Karzinom eine Lebenszeitverlängerung und im Spätstadium eine Linderung der Krankheitsbeschwerden erreichen. Bei der Wahl der konkreten Therapie steht die Erhaltung der Lebensqualität im Vordergrund.[75][68] Darum wird neben den weiter oben beschriebenen Klassifikationen des Tumors auch die körperliche, psychosoziale und emotionale Situation der Patientin berücksichtigt. Eine „Standardtherapie“ gibt es nicht, die Berücksichtigung aller verschiedenen Faktoren führt zu einer individuellen Anpassung der Therapie an die Krankheit und an die jeweilige Patientin.[75][68]
Brustkrebs kann sich sehr schnell im Körper ausbreiten und wird daher schon in frühen Stadien mit einer systemischen (im ganzen Körper wirksamen) Therapie behandelt. Diese nach dem amerikanischen Chirurgen Bernard Fisher benannte „Fisher-Doktrin“ ist die Grundlage der Chemo- und Hormontherapie beim Brustkrebs.[76] Fast immer besteht die Behandlung heute aus einer Kombination verschiedener Therapieformen. Werden zusätzliche Maßnahmen vor einer Operation durchgeführt, werden sie als neoadjuvant bezeichnet, werden sie nach einer Operation eingesetzt, nennt man sie adjuvant.
Neoadjuvante Therapie
In einigen Fällen wird eine Chemotherapie oder antihormonelle Therapie schon vor der chirurgischen Entfernung des Tumors durchgeführt.[77] Diese primäre, oder neoadjuvante Therapie hat einerseits das Ziel, den Tumor zu verkleinern, um eine vollständige Entfernung des Tumors oder sogar eine brusterhaltende Operation zu ermöglichen, andererseits kann an der mit den neoadjuvanten Verfahren erreichbaren Veränderung der Erfolg einer weiteren, adjuvanten Behandlung abgeschätzt werden. Standard ist die neoadjuvante Therapie beim inflammatorischen Karzinom und bei zunächst inoperablen (T4-)Tumoren. Die Chemotherapieschemata sind die gleichen wie bei der postoperativen Behandlung (siehe unten).
Operation
Mit der Operation der Brustkrebserkrankung werden zwei Ziele verfolgt: Einerseits soll durch möglichst vollständige Entfernung der entarteten Zellen eine Ausbreitung (Metastasierung) der Tumorzellen in andere Körperregionen verhindert werden, sofern das noch nicht geschehen ist, andererseits soll ein Wiederauftreten der Krankheitszeichen an Ort und Stelle (ein Rezidiv) verhindert werden.
Brusterhaltende Chirurgie vs. Mastektomie
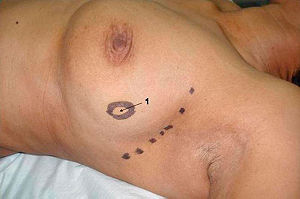

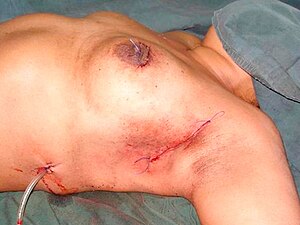


Eine brusterhaltende Therapie (BET) ist heute bei 60–70 % der Erkrankten möglich[77], wenn die Relation zwischen der Tumorgröße und dem Brustvolumen günstig und der Tumor noch nicht in die Muskulatur oder Haut eingedrungen ist. Bei dieser Operation wird entweder der Tumor mit dem umliegenden Gewebe (Lumpektomie), ein größeres Segment oder ein ganzer Quadrant (Quadrantektomie) entfernt. Um ein kosmetisch ansprechendes Ergebnis zu erhalten, wird bei größerer Gewebeentfernung vor allem aus beiden unteren Quadranten eine sogenannte intramammäre Verschiebeplastik vorgenommen. Dabei wird die Brustdrüse ganz oder teilweise von Haut und Muskulatur gelöst und so verschoben, dass nach der Operation trotz des Gewebeverlustes eine ausgeglichene Brustform erhalten bleibt. Ist eine Verschiebeplastik nicht möglich, kann die Brust entweder direkt nach der Tumorentfernung oder nach Abschluss aller Behandlungen rekonstruiert werden.
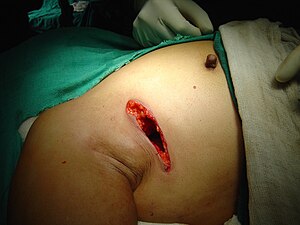
Sollte eine Brusterhaltung nicht möglich sein, wird der gesamte Brustdrüsenkörper und ein Teil der darüber liegenden Haut entfernt (Ablatio, Mastektomie). Die Empfehlung zur Mastektomie wird ausgesprochen, wenn:
- der Tumor sehr groß ist (> 3 cm) oder den Brustmuskel infiltriert hat,
- ein inflammatorisches Karzinom diagnostiziert wurde,
- ein ausgedehnter Befall der Lymphgefäße der Brustdrüse nachgewiesen wurde,
- der Tumor ausgedehnte „Arme“ in die Milchgänge gebildet hat (Duktales in situ Karzinom),
- die gesamte Brustdrüse eine durch die Mammographie nachgewiesene Mikroverkalkung enthält,
- der Tumor trotz Nachoperation nicht mit einem ausreichenden Sicherheitsabstand zum gesunden Gewebe entfernt werden konnte,
- die Patientin dies wünscht. Manche Patientinnen entscheiden sich gegen die Möglichkeit zur brusterhaltenden Operation, um sich sicherer zu fühlen oder um die sonst notwendige Strahlentherapie zu vermeiden.
Die Empfehlung zur Mastektomie wird auch ausgesprochen, wenn ein multizentrisches (Tumorknoten in mehreren Quadranten) oder multifokales (mehrere Tumorknoten im selben Quadranten) Karzinom diagnostiziert wurde. Diese Empfehlung kann manchmal relativiert werden, wenn der Operateur alle Tumoren mit einem ausreichenden Sicherheitsabstand zum gesunden Gewebe entfernen kann.[80][81] Auch wenn eine Krebserkrankung schon in andere Organe metastasiert hat, kann der ursprüngliche Tumor schonender operiert werden, wenn das radikale chirurgische Vorgehen keinen Vorteil bringen würde.
Für die Versorgung von Frauen sowohl nach Brustamputation als auch nach brusterhaltender Operation (Chirurgie) oder auch nach Wiederaufbau mit unzureichendem kosmetischem Ergebnis werden Brustprothesen und Brustausgleichsteile aus Silikon eingesetzt. Frauen nach einer Brustoperation haben in der Regel Anspruch auf die Versorgung mit einer Brustprothese (auch Brustepithese genannt) bzw. einem Brustausgleichsteil, deren Kosten inkl. Beratung und Anpassung dann als medizinisches Hilfsmittel von den Krankenkassen übernommen wird. Als Halterung für die Prothese gibt es spezielle Prothesen-BHs und Prothesen-Badeanzüge mit eingearbeiteten Taschen, die zusammen mit dem Brustausgleich im Sanitätsfachgeschäft erhältlich sind.
Achsellymphknoten
Die Lymphknoten der Achsel sind meist der erste Ort, an dem sich Metastasen bilden. Um diesen Befall zu erfassen, werden die Lymphknoten, zumindest einige von ihnen, bei der Operation in der Regel mit entfernt.
Um die Folgeschäden (Lymphödem) so gering wie möglich zu halten, kann zunächst nur ein einzelner Lymphknoten entfernt und untersucht werden, wenn der Tumor in der Brust kleiner als 2 cm ist und die Achsellymphknoten nicht tastbar sind.[82] Dazu wird in die betreffende Brust ein Farbstoff oder ein Radionuklid injiziert, um den Lymphabfluss darzustellen. Der erste Lymphknoten, in dem das eingespritzte Material nachgewiesen werden kann, wird herausoperiert und untersucht. Nur wenn dieser sogenannte Wächterlymphknoten (sentinel node) von Tumorzellen befallen ist, werden die übrigen Lymphknoten der Achselhöhle ebenfalls entfernt (Axilladissektion). Auch wenn der Wächterlymphknoten nur von einer Mikrometastase befallen ist, wird zurzeit eine Ausräumung der Achselhöhle empfohlen, ob in dieser Situation auf die Entfernung der übrigen Lymphknoten verzichtet werden kann, wurde noch nicht mit einer Studie belegt (Stand 2/2008).
Adjuvante Therapie
Fast alle Patientinnen erhalten nach der Operation eine adjuvante (unterstützende) Behandlung.
Chemotherapie
Nach der Operation folgt für die meisten Patientinnen eine Chemotherapie, um möglicherweise verbliebene Tumorzellen abzutöten. Welche Medikamente verabreicht werden, hängt vom Zustand der Patientin und von der Klassifikation des Tumors ab, vor allem von der Risikogruppe nach der St.-Gallen-Empfehlung. Die Behandlung wird in mehreren Zyklen durchgeführt, beispielsweise insgesamt viermal im Abstand von drei Wochen oder sechsmal in Abstand von zwei Wochen. Der Zeitabstand zwischen den einzelnen Gaben soll dem Körper einerseits die Gelegenheit zur Regeneration geben, andererseits hofft man darauf, dass Mikrometastasen (ruhende Tumorzellen) bzw. Krebsstammzellen in den Erholungsphasen mit der Teilung beginnen und mit der erneuten Zuführung der Zytostatika zerstört werden können.
In der Regel werden die Zytostatika als Kombinationen eingesetzt. Die häufigsten Schemata sind zurzeit AC oder EC, FAC oder FEC. Wenn die Lymphknoten mit Metastasen befallen waren, wird eine Ergänzung der jeweiligen Kombination mit Taxanen (Paclitaxel und Docetaxel) empfohlen (St. Gallen, 2007). Das ältere CMF-Schema wird kaum noch verwendet. (A = Adriamycin, C = Cyclophosphamid, E = Epirubicin, F = Fluoruracil, M = Methotrexat, T = Taxane) Inzwischen werden Chemotherapien auch mit weiteren Therapien wie der zielgerichteten Antiangiogenese („Therapie des metastasierten Mammakarzinoms“, siehe unten) erfolgreich kombiniert.
Bei HER2/neu-positiven Tumoren wird in der Regel im Anschluss an die Chemotherapie ein Jahr lang die Behandlung mit dem HER2-Antikörper Trastuzumab durchgeführt („Antikörper-Therapie“, siehe unten).[83][84][85][86] Die Dauer und die Zusammensetzung der Chemotherapie wird vom Ausmaß der befallenen Lymphknoten mitbestimmt (St. Gallen 2007).
Wenn der Tumor hormonabhängig und die Lymphknoten frei von Metastasen sind, kann unter Umständen auf eine Chemotherapie verzichtet werden. Bei dieser Konstellation können mit einer antihormonellen Therapie ähnliche Ergebnisse erzielt werden (St. Gallen 2007).
Bestrahlung
Nach der brusterhaltenden Operation sollte eine Strahlentherapie der Restbrust erfolgen.[68] Sie senkt die Rezidivrate von 30 auf unter 5 %. Mikroskopisch kleine (nicht mit bloßem Auge erkennbare) Tumorreste können auch bei sorgfältigster Operation in der Brustdrüse verbleiben.
Auch nach einer Mastektomie wird zur Nachbestrahlung geraten, wenn der Tumor größer als 5 cm war (T3 oder T4), die Brustdrüse mehrere Tumoren enthielt oder der Tumor bereits in Haut oder Muskulatur eingedrungen war. Auch der Befall von Lymphknoten ist ein Anlass zur Nachbestrahlung der Brustwand, insbesondere bei mehr als drei befallenen Lymphknoten.
Das ehemalige Tumorgebiet soll bei Frauen unter 60 Jahren mit einer um 10–16 Gy höheren Dosis bestrahlt werden, damit sich an den Schnitträndern keine Rezidive ausbilden können.
Die Strahlentherapie beginnt zirka 4–6 Wochen nach der Operation und dauert sechs bis acht Wochen.
Antihormonelle Therapie
Ist das Karzinom hormonsensitiv, wird zusätzlich eine Therapie mit Hormonantagonisten durchgeführt. Es gibt verschiedene, vom menopausalen Status der Frau abhängige Varianten.
Vor der Menopause:
Eine chirurgische Ovariektomie oder radiotherapeutische Ausschaltung der Ovarfunktion wird nur noch selten vorgenommen. Studien zufolge genügt eine temporäre Ausschaltung der Hormonproduktion über zwei Jahre, die medikamentös erreicht werden kann.[77]
Bei Frauen, die noch die Periode haben, wird schon durch Chemotherapie die Hormonfunktion der Eierstöcke gestört.[87] Dieser Effekt richtet sich auch gegen die hormonabhängigen Tumorzellen und ist daher erwünscht. Frauen mit Kinderwunsch oder Frauen, denen das Risiko einer vorzeitigen Menopause zu groß ist[88], können ihre Eierstöcke mit GnRH-Analoga (die die ovariale Produktion von Östrogen und Progesteron unterdrücken) vor der schädigenden Wirkung schützen und gleichzeitig die Hormonausschaltung bewirken. GnRH-Analoga werden in der Regel über zwei Jahre gegeben.[77]
Nach der Chemotherapie wird normalerweise ein Estrogen-Rezeptor-Modulator wie Tamoxifen, welcher die Anbindung des körpereigenen Östrogens an den Östrogen-Rezeptoren des Tumors verhindert, für 5 Jahre gegeben.[89] Aromatasehemmer sind vor der Menopause nicht angezeigt.
Nach der Menopause:
Ist die Patientin postmenopausal, erhält sie für in der Regel fünf Jahre entweder Tamoxifen oder einen Aromatasehemmer, welcher durch eine Enzymblockade die Bildung von Östrogen im Muskel- und Fettgewebe unterbindet. Neuere Studienergebnisse deuten an, dass die Aromatasehemmer wirksamer sind als das Tamoxifen, das heißt, die krankheitsfreie Überlebenszeit steigt an. In Studien wird der Aromatasehemmer manchmal sofort verwendet (upfront), in der Regelbehandlung erst nach zwei bis drei Jahren unter Tamoxifen (switch, dt. ‚Wechsel‘), oder nach fünf Jahren (extended).[77] Die jeweiligen Nebenwirkungen der Substanzen müssen bei der Entscheidung berücksichtigt werden. Auf Grund der besseren Wirksamkeit sind Aromatasehemmer zu Therapiebeginn erste Wahl und werden entsprechend häufiger verordnet. Tamoxifen wird dagegen seit 2003 immer seltener verschrieben.[90] Eine weitere Möglichkeit besteht in der Gabe eines reinen Estrogen-Rezeptor-Antagonisten (Fulvestrant; Handelsname Faslodex), der von den Arzneimittelbehörden jedoch bisher nur bei fortgeschrittenem Brustkrebs zugelassen ist.[91]
Bei vielen Patientinnen mit hormonabhängigen Tumoren verliert Tamoxifen nach einigen Jahren seine Schutzwirkung (sogenannte Tamoxifenresistenz). Laborversuchen zufolge kann im Gegenteil sogar eine Beschleunigung des Zellwachstums eintreten.[92] Betreffende Frauen sollten besser mit anderen Substanzen behandelt werden. Es ist bislang aber noch nicht möglich, das Verhalten eines individuellen Tumors in dieser Beziehung vorauszusagen. Ein Hinweis könnte das gleichzeitige Auftreten einer HER2/neu- und AIB1-Expression an einem ER-positivem Tumor sein.[93]
Antikörper
Etwa ein Viertel aller Mammakarzinome weisen eine Überexpression des HER2/neu-Rezeptors auf. Der Nachweis dieses Rezeptors steht für einen aggressiven Krankheitsverlauf und eine ungünstige Prognose, ist aber auch Bedingung für die Behandlung (Krebsimmuntherapie) mit dem Antikörper Trastuzumab.
1998 wurde der Wirkstoff (Handelsname Herceptin®) in den USA und 2000 in der Europäischen Union zunächst für Patientinnen mit metastasiertem Brustkrebs zugelassen. Trastuzumab ist ein monoklonaler Antikörper gegen den Wachstumsrezeptor HER2/neu auf der Zelloberfläche von Krebszellen. Studien ergaben, dass mit dieser sogenannten Targeted-Therapy-Substanz das Risiko eines Rezidivs (Wiederauftretens) um etwa 50 % gemindert werden konnte. Viele klinische Studien zeigen, dass auch Frauen ohne Metastasen profitieren. Die HER2-Antikörpertherapie kann Rückfälle verhindern und so zur Heilung beitragen.[83][94][95][84][85] Seit 2006 ist Trastuzumab deshalb auch für die adjuvante Therapie zugelassen.
Therapie des metastasierten Mammakarzinoms
Fernmetastasen verschlechtern die Prognose rapide, da in der Regel bei Vorliegen einer sichtbaren Fernmetastase multiple Mikrometastasen vorhanden sind. Deshalb richtet sich die Behandlung auf die Lebenszeitverlängerung und den Erhalt einer angemessenen Lebensqualität mit einer langfristigen Stabilisierung der körperlichen und psychischen Verfassung. Brustkrebs bildet ausgesprochen häufig Knochenmetastasen.[96]
Rezidive und Metastasen können operativ entfernt oder mit Strahlentherapie behandelt werden. Trotz der Nebenwirkungen kann unter Umständen auch mit der Verabreichung einer Chemo-, Hormon- oder durch eine gezielte Krebstherapie eine Erhöhung der Lebensqualität und eine Verlängerung der Zeit bis zum Fortschreiten der Erkrankung (Progressionsfreies Überleben) erreicht werden. Das zur Gruppe der Taxane gehörende Paclitaxel-Albumin (Handelsname Abraxane®) ist – in Monotherapie – indiziert für die Behandlung von metastasierendem Mammakarzinom bei erwachsenen Patienten, bei denen die Erstlinientherapie für metastasierende Krankheit fehlgeschlagen ist und für die eine standardmäßige Anthracyclin-enthaltende Therapie nicht angezeigt ist.
Zusätzlich zu den bei der adjuvanten Therapie eingesetzten Wirkstoffen kommt beim HER2/neu-positiven metastasierten Mammakarzinom auch der Tyrosinkinase-Inhibitor Lapatinib zum Einsatz. Metastasierte HER2/neu-negative Tumoren können seit 2007 mit dem Angiogenese-Hemmer Bevacizumab behandelt werden. Diese targeted therapy kann in Kombination mit einer Chemotherapie aus Paclitaxel oder Docetaxel angewendet werden. Studien zu weiteren Kombinationsmöglichkeiten laufen zur Zeit.[97] Durch die Antiangiogenese wird die vom Tumor ausgelöste Neubildung von Blutgefäßen verhindert. Infolgedessen wird der Tumor nicht mehr ausreichend versorgt, die Tumorzellen gehen zugrunde.
Eribulin (Handelsname Halaven®) ist ein nicht taxan-basiertes, hochwirksames neues Zytostatikum (Zulassung in den USA November 2010; in Europa März 2011), das in Monotherapie für die Therapie von stark vorbehandelten Patientinnen mit lokal fortgeschrittenem oder metastasiertem Brustkrebs eingesetzt wird.
Wenn der Krebs in seiner Ausbreitung so weit fortgeschritten ist, dass er nicht mehr zurückgedrängt werden kann, richtet sich die Behandlung vor allem auf die Beherrschung von Schmerzen und anderen Krankheitsbeschwerden. Zur Palliativmedizin gehört die psychosoziale Betreuung und eine Schmerzbehandlung, die schnell und vollständig erfolgen sollte und eine frühzeitige und ausreichende Gabe von Opiaten einschließt, siehe WHO-Stufenschema.
Nachsorge
Die Nachsorge der behandelten Patientinnen dauert in der Regel fünf Jahre und richtet sich zumeist nach den Leitlinien der Deutschen Krebsgesellschaft. Auf Nebenwirkungen der Strahlentherapie (Lymphödem, Lungen- oder Herzprobleme), der Chemotherapie (Blutbildveränderungen, Organschäden) und der Hormontherapie (Thrombosen, Osteoporose) muss besonders geachtet werden. Neben der Befragung und klinischen Untersuchung soll in den ersten drei Jahren, da hier die meisten Rezidive auftreten, alle sechs Monate eine Mammographie angefertigt werden. Im vierten und fünften Jahr erfolgt die Mammographie – ebenso wie bei der zweiten, gesunden Brust von Anfang an – jährlich. Zur Verlaufskontrolle können in der Blutuntersuchung die Tumormarker CA 15-3 und CEA bestimmt werden, was allerdings nicht in den Richtlinien vorgesehen ist und meistens eher bei konkretem Verdacht der Fall ist. Es muss bei jeder einzelnen Patientin sehr sorgfältig abgewogen werden, ob die Nachsorge in der hier angegebenen Form tatsächlich durchgeführt werden soll; jede kleine nachgewiesene Veränderung kann eine erhebliche psychische Belastung nach sich ziehen, die wiederum die Lebensqualität entscheidend beeinflussen kann.
Für eine einheitliche Qualität bei der Nachbetreuung bieten die deutschen gesetzlichen Krankenkassen seit 2004 das Disease-Management-Programm „Brustkrebs“ an. Die teilnehmenden Ärzte orientieren sich bei der Therapie an den jeweils aktuellen Leitlinien zur Behandlung und Nachsorge des Brustkrebses. Eine Teilnahme ist bei allen Ärzten möglich, die sich diesen qualitätssichernden Programmen angeschlossen haben. Für die Patientinnen bedeutet die Teilnahme an diesem Programm eine Einschränkung der freien Arztwahl.
Geschichte
Die ersten Dokumentationen von Brustkrebserkrankungen stammen aus der Zeit von 2650 v. Chr. aus dem Alten Ägypten. Zu dieser Zeit wurden sie mit einem Brenneisen behandelt. Im Papyrus Edwin Smith (um 1600 v. Chr.) wurden acht Brustkrebserkrankungen beschrieben, auch die eines Mannes,[98] welche ebenfalls durch Kauterisation behandelt wurden. Auch das Papyrus Ebers enthält eine Beschreibung von Brustkrebs. Die Erkrankungen galten zur damaligen Zeit als nicht heilbar.[99][100][101]
Auch im Corpus Hippocraticum wurde der Fall eines Mammakarzinoms geschildert.[102] Von einer chirurgische Behandlung tiefliegender Tumorerkrankungen wurde dort abgeraten, da nicht operierte Patienten länger lebten.[103]
Der griechische Arzt Galen sah Brustkrebs als Folge einer Säftestörung und damit als systemische Erkrankung, eine Krankheit des ganzen Organismus, an.[99][100] Als Mittel zur Behandlung wurden bis in das Mittelalter unterschiedlichste Rezepturen genutzt, um die eingedickte Galle zu verflüssigen und abzuführen. Bestandteile waren, unter anderem, Blei- und Zinkkarbonat, Rosenöl und Hirschkot.[104]
Die erste Operation bei Brustkrebs soll Leonidas aus Alexandria um 100 n. Chr. durchgeführt haben. Zur Blutstillung und Entfernung von Tumorresten nutzte er ein Brenneisen.[104] Andreas Vesalius empfahl um 1543 bei Brustkrebs eine Entfernung der Brust (Mastektomie), bei welcher er jedoch eine Blutstillung mit Nähten der Kauterisation vorzog.[100]
Der französische Chirurg Jean-Louis Petit (1674–1750) legte das erste Konzept zur operativen Behandlung von Brustkrebs vor, welches jedoch erst 24 Jahre nach seinem Tode veröffentlicht wurde.[105] Sein Kollege Henry François Le Dran (1685–1770) meinte 1757, dass der Brustkrebs zumindest am Anfang lokaler Natur wäre. Erst wenn er sich seinen Weg in die Lymphbahnen geschaffen habe, sei die Prognose für die Patientin schlecht. Er entfernte daher die komplette Brust mitsamt den Lymphknoten der Achselhöhle.[105] Auch der schottische Chirurg Benjamin Bell (1749–1806) erkannte die Bedeutung einer Entfernung der Lymphknoten aus der Achselhöhle.[106]
Rudolf Virchow (1821–1902) konnte 1840 nachweisen, dass sich die Erkrankung aus den Epithelzellen entwickelt und sich entlang der Faszien und Lymphbahnen ausbreitet. Damit wandelte sich die Sicht vom Brustkrebs, welcher jetzt eher als lokale Erkrankung betrachtet wurde.[100][105]
Diesem Konzept folgte William Stewart Halsted (1852–1922), der 1882 die erste radikale Mastektomie mit Entfernung der Faszie, der Brustmuskeln (Musculus pectoralis minor, Musculus pectoralis major) und der Achsellymphknoten durchführte. Für die damaligen Verhältnisse konnte damit eine lokale Tumorkontrolle mit einer 5-Jahres-Lokalrezidivrate von 6 Prozent erreicht werden.[107] Im deutschsprachigen Raum war Josef Rotter (1857–1924) Vorreiter dieser Methode, die er ab 1889 bei seinen Patientinnen durchführte.[108]
1874 beschrieb der englische Chirurg James Paget (1814–1899) eine ekzemartige Veränderung der Brustwarze mit angrenzendem duktalen Adenokarzinom, welche später als Morbus Paget bezeichnet wurde.[100]
Der schottische Chirurg Sir George Thomas Beatson erkannte 1895, dass die Entfernung der Eierstöcke bei einer seiner Patientinnen den Brusttumor schrumpfen ließ.[99][100] 1897 wurde Brustkrebs erstmalig bestrahlt.[104] 1927 wurde in Deutschland über die erste brusterhaltende Operation beim Mammakarzinom berichtet.[109]
1948 veröffentlichten David H. Patey und W. H. Dyson eine etwas weniger radikale Operationsmethode als Rotter und Halsted mit gleich guten Ergebnissen, bei welcher die Brustmuskeln erhalten bleiben konnten.[110] Sie wird heute noch als modifiziert-radikale Mastektomie nach Patey bezeichnet. Ein weiterer Rückgang der operativen Radikalität begann mit Robert McWhirter, der 1948 nach einfacher Mastektomie eine Strahlentherapie durchführte.[111]
Mit den Arbeiten von Bernhard und E. R. Fisher setzte sich in den 60er Jahren des 20. Jahrhunderts die Auffassung durch, dass das Mammakarzinom schon im Frühstadium eine im Körper gestreute Erkrankung sein kann und die Lymphknoten keine Barriere gegen eine Ausbreitung im Körper darstellen. Vielmehr wurde der Befall der Lymphknoten als Indikator für eine systemische Ausbreitung angesehen. Die Lymphknotenentfernung hätte folglich nur prognostische und keine therapeutische Bedeutung.[112] Daher wurde das gängige Konzept der Operation und Strahlentherapie um eine anschließende Chemotherapie ergänzt, um auch Mikrometastasen zu vernichten.[113] Ab 1969 erfolgte die Chemotherapie als Kombination mehrerer Präparate mit Verbesserung der Wirksamkeit.[104]
Seit den 70er Jahren des 20. Jahrhunderts werden Mammakarzinome zunehmend brusterhaltend operiert. Die Sentinel- oder auch Wächter-Lymphknoten-Entfernung erspart seit Ende des 20. Jahrhunderts oft die vollständige Entfernung der Lymphknoten aus der Achselhöhle. Damit wurde die operative Radikalität weiter reduziert.[105]
Eine Forschergruppe um den US-Amerikaner J. M. Hall entdeckte 1990 das, später BRCA1 benannte, Brustkrebs-Gen.[114] 1994 wurde mit BRCA2 ein zweites Brustkrebsgen erkannt.[115][116]
Brustkrebszeichen in der Kunst
In der medizinischen Fachliteratur wurde wiederholt über Brustkrebsanzeichen in historischen Bildern diskutiert. Anzeichen, wie ein sich andeutender Tumor, Größen- und Umrissveränderungen der Brust im Seitenvergleich, Hautrötung, Hauteinziehung oder Apfelsinenhaut finden sich beispielsweise in Werken von Raffael, Rembrandt van Rijn und Rubens.[117][118][119][120] Ob es sich bei den dargestellten Veränderungen allerdings tatsächlich um Brustkrebs handelt, lässt sich jedoch nicht beweisen und wurde daher auch angezweifelt.[121]
- Beispiele für Brustkrebszeichen in der Kunst
Literatur
- Leitlinien
- S3-Leitlinie Brustkrebs-Früherkennung der Deutschen Gesellschaft für Senologie und der deutschen Krebshilfe e. V. In: AWMF online (Stand Februar 2008)
- S3-Leitlinie Diagnostik, Therapie und Nachsorge des Mammakarzinoms der Frau der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) und der Deutsche Krebsgesellschaft (DKG). In: AWMF online (Stand 2012)
- Lehrbücher
- David J. Winchester, David P. Winchester, Clifford A. Hudis, and Larry Norton (Hrsg.): Breast Cancer (Atlas of Clinical Oncology). B.C. Decker, Hamilton, Ontario 2006, ISBN 1-55009-272-3.
- Orlando Silva, Stefano Zurrida (Hrsg.): Brustkrebs: Diagnostik und Therapie. Urban & Fischer, München 2007, ISBN 3-437-24260-1.
- Manuela Eicher, Sara Marquard (Hrsg.): Brustkrebs. Lehrbuch für Breast Care Nurses, Pflegende und Gesundheitsberufe. 1. Auflage. Huber, Bern 2008, ISBN 3-456-84556-1.
- Ratgeber
- Lilo Berg: Brustkrebs. Wissen gegen die Angst. Das Handbuch. Goldmann Taschenbuch 15168, München 2007, ISBN 3-442-15168-6.
- Hermann Delbrück: Brustkrebs – Rat und Hilfe für Betroffene und Angehörige. 8. Auflage. Kohlhammer, Stuttgart 2009, ISBN 978-3-17-020469-0.
- Angela Hasser: Neun Frauen und ich. Ein Buch über Brustkrebs, Heilung, Hoffnung und Erotik. Mikado, Hamburg 2000, ISBN 3-935436-00-9.
- Heinrich Schmidt-Matthiesen, Gunther Bastert, Diethelm Wallwiener (Hrsg.): Gynäkologische Onkologie. 7. Auflage. Schattauer, Stuttgart 2002, ISBN 3-7945-1974-4.
- Verschiedene Informationsbroschüren zum Thema „Brustkrebs“ der Deutschen Krebsgesellschaft. (PDF).
Weblinks
- Links zum Thema Brust (Krebs) im Open Directory Project
- Wege zur Prävention von Brustkrebs Breast Cancer Action Germany
- Brustkrebs – Informationen bei Gesundheitsinformation.de (Online-Angebot des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen)
- uPA/PAI-1-Test nach Brustkrebs-OP – Chancen und Risiken
- Patientenleitlinie Brustkrebs. Die Ersterkrankung und DCIS – Eine Leitlinie für Patientinnen (PDF; 0,57 MB, Deutsche Krebsgesellschaft)
- Brustkrebs II. Die fortgeschrittene Erkrankung, Rezidiv und Metastasierung (PDF; 1,11 MB, Deutsche Krebsgesellschaft)
- Übersicht nationale, europäische und internationale Brustkrebs-Leitlinien Breast Cancer Action Germany
- Brustkrebs – die blauen Ratgeber Nr. 2 der Deutschen Krebshilfe. (PDF-Datei; 860 kByte)
- Patientenratgeber Brustkrebs (PDF; 1,5 MByte, Deutsche Krebsgesellschaft)
- Ratgeber „Individuelle Brustkrebstherapie“ (PDF, 9,6 MB)
- Krebsinformationsdienst am DKFZ Heidelberg, Seite „Brustkrebs“
- Internetportal der Deutschen Krebsgesellschaft, Patienteninformationen zu Brustkrebs
- Verein „Brustkrebs – Wissen hilft weiter“
- Entscheidungshilfen: Brustkrebs – Was kommt danach? und Brusterhaltende Therapie oder Brustentfernung? AOK
- Informationen zu Brustkrebs vom Zentrum für Krebsregisterdaten im Robert Koch-Institut
Einzelnachweise
- ↑ M. A. Roubidoux:Breast cancer, male. In: Emedicine, Stand vom 24. September 2008
- ↑ Robert-Koch-Institut – Krebs in Deutschland 2007–2008: Brustdrüse der Frau
- ↑ Alexander Katalinic, Carmen Bartel: Epidemiologie Mammakarzinom. Universität Lübeck, 2006.
- ↑ WHO/IARC: World Cancer Report. Lyon 2003
- ↑ Ärzte Zeitung, 1. September 2008, Brustkrebs bei Frauen häufigste Todesursache
- ↑ 6,0 6,1 Zusammenstellung der Daten des Statistischen Bundesamtes Deutschland aus den Jahren 2003 bis 2006, Fachserie 12, Reihe 4 Datensatz: Todesursache Mammakarzinom
- ↑ www.aerzteblatt.de vom 25.Oktober 2011
- ↑ Backe, Jael: Brustkrebs beim Mann. Deutsches Ärzteblatt 2002; 99 (17): A-1168/B-970/C-913
- ↑ Hui Miao, Helena M. Verkooijen, Kee-Seng Chia, Christine Bouchardy, Eero Pukkala, Siri Larønningen, Lene Mellemkjær, Kamila Czene, Mikael Hartma: Incidence and Outcome of Male Breast Cancer: An International Population-Based Study. JCO 29 (2011), 4381-4386, doi:10.1200/JCO.2011.36.8902
- ↑ Deutsche Krebshilfe, Pressemitteilung 27. Oktober 2011
- ↑ Deutsche Krebsgesellschaft: Patientinneninformation, 5. Juni 2007, „Familiäre Vorbelastung“
- ↑ Antoniou A, Pharoah PD, Narod S et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case Series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet. 72: 1117–30, 2003. PMID 12677558
- ↑ M. R. Stratton, N. Rahman:The emerging landscape of breast cancer susceptibility. In: Nature Genetics 40/2008, S. 17–22. PMID 18163131
- ↑ Schmutzler R, Meindl A: Das hereditäre Mammakarzinom: Genetik und Prävention. In: Aktuelle Empfehlungen zur Therapie primärer und fortgeschrittener Mammakarzinome (Hrsg. C. Thomssen für die Kommission Mamma der Arbeitsgemeinschaft Gynäkologische Onkologie e. V.). Zuckschwerdt-Verlag, 2007, ISBN 3-88603-916-1
- ↑ K. Hemminki, A. Försti, J. Lorenzo Bermejo: Surveying germline genomic landscape of breast cancer. In: Breast Cancer Res. Treat. 113, 2009, S. 601–603 PMID 18297427.
- ↑ Familial breast cancer. Lancet 2001 (358):1389-99, zitiert nach Uta Wagenmann: Auf der Suche nach dem magischen Krebs-Gen. Freitag, 26. April 2002
- ↑ Schmutzler, K. u. a.: Familiärer Brust- und Eierstockkrebs: Von der Forschung zur Regelversorgung Dtsch Arztebl 102(50): A-3486, 2005
- ↑ Internet/Behelfsquelle: [1]
- ↑ Siegmund-Schultze N, et al.: Hormontherapie und Brustkrebs: Ein Blick auf aktuelle Datenlage. Dtsch Ärztebl. 2008 (105): A-260 / B-234 / C-230
- ↑ U. Ackermann-Liebrich: Stillen als Prävention gegen Brustkrebs. infomed.org, November/Dezember 2002. Nach einer Veröffentlichung in The Lancet, 260/2002, S. 187–195.
- ↑ V. Beral u. a.: Breast cancer and abortion: collaborative reanalysis of data from 53 epidemiological studies, including 83.000 women with breast cancer from 16 countries. In: The Lancet 363/2004, S. 1007–1016. PMID 15051280
- ↑ D. H. Brewster u. a.: Risk of breast cancer after miscarriage or induced abortion: a Scottish record linkage case-control study. In: J Epidemiol Community Health 59/2005, S. 283–287. PMID 15767381
- ↑ X. Paoletti, F. Clavel-Chapelon: Induced and spontaneous abortion and breast cancer risk: results from the E3N cohort study. In: Int J Cancer 106/2003, S. 270–276. PMID 12800205
- ↑ G. K. Reeves u. a.: Breast cancer risk in relation to abortion: Results from the EPIC study. In: Int J Cancer 119/2006, S. 1741–1745. PMID 16646050
- ↑ Rice S, Whitehead SA: Phytoestrogens and breast cancer –promoters or protectors? Endocrine-Related Cancer 2006 (13):995–1015
- ↑ Cornell University:Phytoestrogens and Breast Cancer., Juli 2001, abgerufen am 25. November 2009
- ↑ M. K. Ramadhani u. a.: Innate left handedness and risk of breast cancer: case–cohort study. In: BMJ 331, 2005, S. 882–883. PMID 16186135
- ↑ Brustkrebs – Erhöhtes Risiko bei Linkshänderinnen. In: Der Spiegel vom 26. September 2005
- ↑ Mehr Brustkrebs bei Linkshänderinnen. In: scinexx vom 26. September 2005
- ↑ 30,0 30,1 L. Titus-Ernstoff u. a.: Left-handedness in relation to breast cancer risk in postmenopausal women. In: Epidemiology 11, 2000, S. 181–184. PMID 11021617
- ↑ L. Fritschi u. a.: Left-handedness and risk of breast cancer. In: Br J Cancer 97, 2007, S. 686–687. PMID 17687338
- ↑ D. Trichopoulos: Hypothesis: does breast cancer originate in utero. In: The Lancet 335, 1990, S. 939–940. PMID 1970028
- ↑ N. Geschwind und A. M. Galaburda: Cerebral lateralization: biological mechanisms, associations, and pathology. I. A hypothesis and a program for research. In: Arch Neurol 42, 1985, S. 428–459.
- ↑ V. Llaurens u. a.: Why are some people left-handed? An evolutionary perspective. In: Phil Trans R Soc B 364, 2009, S. 881–894. doi:10.1098/rstb.2008.0235 PMID 19064347 (Review)
- ↑ 35,0 35,1 35,2 R. Roychoudhuri u. a.: Cancer and laterality: a study of the five major paired organs (UK). In: Cancer Causes Control 17, 2006, S. 655–662. PMID 16633912
- ↑ A. Ekbom u. a.: Epidemiologic correlates of breast cancer laterality (Sweden) In: Cancer Causes Control 5, 1994, S. 510–516. PMID 7827237
- ↑ H. A. Weiss u. a.: Laterality of breast cancer in the United States. In: Cancer Causes Control 7, 1996, S. 539–543. PMID 8877052
- ↑ C. I. Perkins u. a.: Association between breast cancer laterality and tumor location, United States, 1994–1998. In: Cancer Causes Control 15, 2004, S. 637–645. PMID 15280621
- ↑ M. T. Goodman u. a.: Comparative epidemiology of breast cancer among men and women in the US, 1996 to 2000. In: Cancer Causes Control 17, 2006, S. 127–136. PMID 16425090
- ↑ S. Dane u. a.: Asymmetries in breast cancer lateralization and both axillary lymph node number and metastatic involvement. In: Lymphology 41, 2008, S. 75–79. PMID 18720914
- ↑ 41,0 41,1 O. Hallberg, O. Johansson: Sleep on the right side-Get cancer on the left? In: Pathophysiology 17, 2010, S. 157–160 PMID 19647986.
- ↑ L. Titus-Ernstoff u. a.: Left-handedness in relation to breast cancer risk in postmenopausal women. In: Epidemiology 11, 2000, S. 181–184.
- ↑ M. A. Kramer u. a.: Handedness and the laterality of breast cancer in women. In: Nurs Res 34, 1985, S. 333–337.
- ↑ Häufig gestellte Fragen. Abgerufen am 27. November 2009
- ↑ E. Nekolla: Epidemiologie des strahleninduzierten Mammakarzinoms. Dissertation, LMU München, 2004.
- ↑ F. A. Mettler u. a.: Benefits versus risks from mammography: a critical reassessment. In: Cancer 77/1996, S.903–9. PMID 8608482
- ↑ 47,0 47,1 Women’s Health Initiative, zitiert nach Gyne online, 4. Juni 2007
- ↑ Reynolds P, et al.: Active smoking, household passive smoking, and breast cancer: evidence from the California Teachers Study. Journal of the National Cancer Institute 2004 (96):29-37
- ↑ Sonnenmangel fördert Krebs!, Medical Tribune, 42. Jg., Nr. 23, 8. Juni 2007, S. 21
- ↑ J. M. Lappe u. a.: Vitamin D and calcium supplementation reduces cancer risk: results of a randomized trial. In: The American journal of clinical nutrition 85/2007, S. 1586–91. PMID 17556697
- ↑ In/Fo/Onkologie 2009, 12 (8): 18, zitiert nach Brustkrebs: Schlechte Prognose bei Vitamin-D-Mangel In: Ärzte Zeitung vom 4. Mai 2010, S. 12.
- ↑ 52,0 52,1 cancer.org: Detailed Guide: Breast Cancer – What Are the Risk Factors for Breast Cancer? abgerufen am 6. Mai 2008
- ↑ Smollich M, Götte M, Kersting C, Fischgräbe J, Radke I, Kiesel L, Wülfing P: On the role of Endothelin-Converting Enzyme-1 (ECE-1) and neprilysin in human breast cancer. Breast Cancer Res Treat 2007 106:361-369. PMID 17295044
- ↑ Aiello EJ, et al.: Rate of breast cancer diagnoses among postmenopausal women with self-reported breast symptoms. J American Board of Family Practice 2004 (17):408-15
- ↑ Thomas DB, et al.: Randomized Trial of Breast Self-Examination in Shanghai: Final Results. Journal of the National Cancer Institute 2002 (94):1445-57
- ↑ J. P. Kösters, P. C. Gøtzsche: Regular self-examination or clinical examination for early detection of breast cancer. In: Cochrane Database Syst Rev 2/2003, S. CD003373. PMID 12804462
- ↑ 57,0 57,1 Agency for Healthcare Research and Quality: Screening for Breast Cancer. vom Februar 2002, abgerufen am 27. November 2009
- ↑ Canadian Task Force on Preventive Health Care:Jolie Ringash and the Canadian Task Force on Preventive Health Care: Preventive health care, 2001 update: screening mammography among women aged 40-49 years at average risk of breast cancer. Abgerufen am 27. Dezember 2009
- ↑ Silikonmodell zur Brustselbstuntersuchung. In: Constanze Schäfer, Ingo Donieth: Hilfsmittel und Medizinprodukte. Wissenschaftliche Verlagsgesellschaft mbH. Stuttgart 2003, ISBN 3-8047-1948-1.
- ↑ 60,0 60,1 S3-Leitlinie Brustkrebs-Früherkennung der Deutschen Gesellschaft für Senologie und der deutschen Krebshilfe e. V., 2008. Abgerufen am 27. November 2009
- ↑ MR-Tomographie findet mehr Tumore. Vom 29. März 2007.
- ↑ Mammographie-Screening-Programm. Vom 20. Januar 2011, abgerufen am 10. Januar 2012.
- ↑ Deutsche Programmrichtlinie für das Mammographiescreening, PDF, siehe S. 43
- ↑ S. Fabbri u. a.: Benign Breast Diseases in Breast Cancer Screening Programs in Italy 2000–2001. (PDF) In: Tumori 90, 2004, S. 547–549.
- ↑ P. Taylor und H. W. Potts: Computer Aids and Human Second Reading as Interventions in Screening Mammography. In: Eur J Cancer. 44, 2008, S. 798–807. PMID 18353630
- ↑ J. Baltzer, H.-G. Mehrpohl, J. Bahnsen: Praxis der gynäkologischen Onkologie. 2. Auflage. Band 3. Georg Thieme Verlag, 2000, ISBN 3-13-109912-7, S. 296 ([2]).
- ↑ Ultraschall-Vereinbarung gem. §135 Abs. 2 SGB V, Stand 2003
- ↑ 68,0 68,1 68,2 68,3 68,4 S3-Leitlinie Diagnostik, Therapie und Nachsorge des Mammakarzinoms der Frau der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG) und der Deutsche Krebsgesellschaft (DKG). In: AWMF online (Stand 2012)
- ↑ S. Lakhani, I.O. Ellis, S.J. Schnitt, M.J. van de Vijver: WHO Classification of Tumours of the Breast, Fourth Edition. International Agency for Research on Cancer, Lyon 2012, ISBN 978-92-832-2433-4 (openlibrary.org).
- ↑ S3-Leitlinie Mammakarzinom der Dt. Krebsgesellschaft S. 28–29, S. 185
- ↑ American Society of Clinical Oncology/College of American Pathologists Guideline Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer. Arch Pathol Lab Med 2007 (131): (PDF)
- ↑ Goldhirsch A, Wood WC, Gelber RD, Coates AS, Thürlimann B, Senn HJ; 10th St. Gallen conference. Progress and promise: highlights of the international expert consensus on the primary therapy of early breast cancer 2007. Ann Oncol. 2007 Jul;18(7):1133-44 (PDF) PMID 17675394
- ↑ Carey LA, et al.: Race, Breast Cancer Subtypes, and Survival in the Carolina Breast Cancer Study. JAMA 2006 (295):2492–2502
- ↑ Deutsche Krebsgesellschaft: Deutsche Krebsgesellschaft verleiht offiziell erstes „Zertifikat Brustzentrum“. Vom 21. Juli 2003
- ↑ 75,0 75,1 75,2 „Anforderungen an strukturierte Behandlungsprogramme für Patientinnen mit Brustkrebs“, Anlage 3 zu §§ 28b bis 28 g der Risikostrukturausgleichs-Verordnung nach § 137f SGB Fünftes Buch (V)
- ↑ K. Travis: Bernard Fisher reflects on a half-Century’s worth of breast cancer research. In: Journal of the National Cancer Institute 97, 2005, S. 1636–1637
- ↑ 77,0 77,1 77,2 77,3 77,4 W. Janni u. a.: Zertifizierte medizinische Fortbildung: Therapie des primären, invasiven Mammakarzinoms. In: Dtsch Ärztebl 102, 2005, S. A-2795 / B-2360 / C-2226
- ↑ 78,0 78,1 78,2 V. Naraynsingh u. a.: Immediate breast reconstruction following segmentectomy using a latissimus dorsi 'myoadipose' flap through a single axillary incision: a case series. In: Cases Journal 2, 2009, 8116. PMID 19830050 (Open Access, unter CC-by-3.0-Lizenz)
- ↑ 79,0 79,1 S. Reefy u. a.: Oncological outcome and patient satisfaction with skin-sparing mastectomy and immediate breast reconstruction: a prospective observational study. In: BMC Cancer 2010, 10:171 doi:10.1186/1471-2407-10-171 (Open Access, unter CC-by-2.0)
- ↑ W. F. Hartsell u. a.: Should multicentric disease be an absolute contraindication to the use of breast-conserving therapy? In: Int J Radiat Oncol Biol Phys 30, 1994, S. 49–53. PMID 8083128
- ↑ O. Gentilini u. a.: Conservative surgery in patients with multifocal/multicentric breast cancer.' In: Breast Cancer Res Treat 2008, E-Publication, PMID 18330695
- ↑ T. Kühn u. a.: Sentinel-Node-Biopsie beim Mammakarzinom. In: Geburtsh Frauenheilk 63, 2003, S. 835–840.
- ↑ 83,0 83,1 E. H. Romond, E. A. Perez, J. Bryant, u.a.: Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. In: The New England journal of medicine Band 353, Nummer 16, Oktober 2005, S. 1673–1684, ISSN 1533-4406. doi:10.1056/NEJMoa052122. PMID 16236738.
- ↑ 84,0 84,1 E. A. Perez, E. H. Romond, u.a.: Updated results of the combinated analysis of NCCTG N9831 and NSABP B-31 adjuvant chemotherapy with/without trastuzumab in patients with HER2-positive breast cancer. In: J Clin Oncol 2007 ASCO Annual Meeting Proceeding 25 (Suppl 18S): 2007, 6s (abstract 512)
- ↑ 85,0 85,1 M. J. Piccart-Gebhart, M. Procter, u.a.: Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. In: The New England journal of medicine Band 353, Nummer 16, Oktober 2005, S. 1659–1672, ISSN 1533-4406. doi:10.1056/NEJMoa052306. PMID 16236737.
- ↑ L. Gianni, A. Goldhirsch, u.a.: Update of the HERA trial and the role of 1 year trastuzumab as adjuvant therapy for breast cancer. In: Breast 2009; 18(Suppl 1): S11 (abstract S25)
- ↑ S. von Otte u. a.: Fertilitätserhalt bei onkologischen Patientinnen: Stand und Perspektiven. In: Dtsch Arztebl 103, 2006, S. A 2479–2483.
- ↑ Vorzeitige Menopause schädigt Gehirn und Nerven
- ↑ G. von Minckwitz: For The Breast Commission of the German Gynaecological Oncology Working Group (AGO). Evidence-based treatment of metastatic breast cancer – 2006 recommendations by the AGO Breast Commission. In: Eur J Cancer 42, 2006, S. 2897–2908. PMID 17046240
- ↑ dapi.de: 46 % mehr Brustkrebspatientinnen mit modernen Aromatasehemmern seit 2003 versorgt. Verein Deutsches Arzneiprüfungsinstitut, vom 13. November 2012
- ↑ ema.europa.eu: Faslodex. European Medicines Agency, vom März 2010
- ↑ D. F. Hayes: Tamoxifen: Dr. Jekyll and Mr. Hyde? In: Journal of the National Cancer Institute Band 96, Nummer 12, Juni 2004, S. 895–897, ISSN 1460-2105. PMID 15199102.
- ↑ C. K. Osborne, V. Bardou, T. A. Hopp, G. C. Chamness, S. G. Hilsenbeck, S. A. Fuqua, J. Wong, D. C. Allred, G. M. Clark, R. Schiff: Role of the estrogen receptor coactivator AIB1 (SRC-3) and HER-2/neu in tamoxifen resistance in breast cancer. In: Journal of the National Cancer Institute Band 95, Nummer 5, März 2003, S. 353–361, ISSN 0027-8874. PMID 12618500.
- ↑ , Slamon D, Eiermann W, Robert N et al., BCIRG 006: 2nd interim analysis phase III randomized trial comparing doxorubicin and cyclophosphamide followed by docetaxel (ACT) with doxorubicin and cyclophophamide followed by docetaxel and trastuzumab (ACTH) with docetraxel, carboplatin and trastuzumab (TCH) in HER2neu positive early breast cancer patients. Breast Cancer Res Treat 2006; 100(Suppl 1): abstr 52
- ↑ , Slamon D, Eiermann W, Robert N et al., Presentation at the 29th SABCS, San Antonio, Texas, USA, 14-17 December 2006
- ↑ B. Krempien: Die Entstehung von Knochenschmerzen bei Knochenmetastasen und ihre Behandlung durch Bisphophonate. In: H. H. Bartsch, W. Hornstein (Herausgeber): Interdisziplinäre Schmerztherapie bei Tumorpatienten. Karger Publishers, 1998, ISBN 3-8055-6594-1, eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Robert N et al., 2009, J Clin Oncol 27: 15S, Suppl: Abstract 1005
- ↑ Sameh M. Arab: Medicine in ancient Egypt
- ↑ 99,0 99,1 99,2 A History of Breast Cancer
- ↑ 100,0 100,1 100,2 100,3 100,4 100,5 Orlando E. Silva, Stefano Zurrida: Brustkrebs: Diagnostik und Therapie. Elsevier, Urban & Fischer Verlag, 2007, ISBN 3-437-24260-1 (Volltext in der Google-Buchsuche).
- ↑ The History of Cancer. In: American Cancer Society. 9. März 2009. Abgerufen am 26. März 2010.
- ↑ Corpus Hippocraticum: Epidemien 5,101.
- ↑ Corpus Hippocraticum: Aphorismen 6,38.
- ↑ 104,0 104,1 104,2 104,3 Hermann Delbrück: Brustkrebs: Rat und Hilfe für Betroffene und Angehörige. W. Kohlhammer Verlag, 2008, ISBN 3-17-020469-6 (Volltext in der Google-Buchsuche).
- ↑ 105,0 105,1 105,2 105,3 Manfred Kaufmann, Ismail Jatoi, Jean Petit: Atlas der Brustchirurgie. Springer Verlag, 2007, ISBN 3-540-48881-2 (Volltext in der Google-Buchsuche).
- ↑ Benjamin Bell: Lehrbegriff der Wundarzneykunst, Band 6. 3. Auflage. Weidmann, 1809 (Volltext in der Google-Buchsuche).
- ↑ William Stewart Halsted: The results of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June, 1889 to January, 1894. Ann Surg 20 (1894), 497
- ↑ Josef Rotter: Günstige Dauererfolge durch ein verbessertes Operationsverfahren der Mammakarzinome. Berl. klin. Wschr 33 (1896), 69
- ↑ J Hirsch: Radiochirurgie des Brustkrebses. Dtsch Med Wochenschr 34 (1927), 1419-21
- ↑ David H. Patey, W. H. Dyson: Prognosis of carcinoma of the breast in relation to the type of operation performed. Br J Cancer 2 (1948), 7–12
- ↑ Robert McWhirter: Simple Mastectomy and Radiotherapy in the Treatment of Breast Cancer. British Journal of Radiology 28 (1955), 128–139
- ↑ Bernard Fisher, E. R. Fisher: Transmigration of lymph nodes by tumor cells. Science (1966) 152, 1397–1398
- ↑ Renate Leinmüller: Brustkrebs: Primäre Chemotherapie als prognostischer Marker. Dtsch Arztebl 1998; 95(44): A-2753, online
- ↑ Miki Y et al., A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1. Science 266 (1994), 66–71
- ↑ Wooster R et al., Localization of a breast cancer susceptibility gene, BRCA2, to chromosome 13q12-13. Science 265 (1994), 2088–90
- ↑ Terea Wagner et al.: Hereditärer Brust- und Eierstockkrebs. In: Detlev Ganten, Klaus Ruckpaul: Molekularmedizinische Grundlagen von hereditären Tumorerkrankungen. Birkhäuser, 2001, S. 257, ISBN 3-540-67808-5 Volltext in der Google-Buchsuche
- ↑ Juan J. Grau, Jorge Estapé, Matías Diaz-Padrón: Breast cancer in Rubens paintings. Breast Cancer Res Treat. 68 (2001), 89-93, PMID 11678312, doi:10.1023/A:1017963211998
- ↑ C. H. Espinel: The portrait of breast cancer and Raphael's La Fornarina. Lancet. 360 (2002), 2061-3, PMID 12504417
- ↑ Peter Allen Braithwaite, Dace Shugg: Rembrandt's Bathsheba: the dark shadow of the left breast. Ann Roy Coll Surg Engl 65 (1983), 337-8 online (PDF-Dokument; 924 kB)
- ↑ James Stuart Olson: Bathsheba's Breast. JHU Press, 2005, ISBN 0-8018-8064-5 (Volltext in der Google-Buchsuche).
- ↑ Adam Gross: An Epidemic of Breast Cancer Among Models of Famous Artists. Breast Cancer Res Treat. 84 (2004), 293, PMID 15026627, doi:10.1023/B:BREA.0000019965.21257.49